The management of type 2 inflammatory respiratory diseases: a Chinese expert consensus [2024](2型炎症性呼吸系统疾病管理:中国专家共识[2024])于4月30发表于J Thorac Dis 杂志。5月24日,南山呼吸论坛——支气管哮喘高峰论坛暨广东省呼吸与健康学会过敏专委会年度学术会议上,共识通过媒体发布与大家正式见面。

共识全面概述了2型炎症性呼吸系统疾病的发病机制、2型炎症的评估方法、针对2型炎症的生物制剂治疗方案,以及2型炎症性呼吸系统疾病及其共病的管理策略。本文将带你一览共识核心要点,一文掌握共识的核心内容。
一、共识背景与核心意义
2型炎症(T2炎症)是多种呼吸系统疾病的共同病理生理基础,其核心特征为Th2细胞和ILC2介导的IL-4、IL-5、IL-13通路异常激活,导致嗜酸性粒细胞浸润、气道上皮屏障破坏及黏液高分泌。在呼吸领域,这类疾病涵盖了哮喘、过敏性支气管肺曲霉病(allergicbronchopulmonary aspergillosis,ABPA)、嗜酸性肉芽肿性多血管炎(eosinophilic granulomatosis with polyangiitis,EGPA)、部分慢性阻塞性肺疾病(chronic obstructivepulmonary disease,COPD,简称“慢阻肺病”)和非囊性纤维化支气管扩张以及其他相关疾病等。针对减轻2型炎症的生物制剂治疗手段,深刻改变了这类呼吸系统疾病的治疗前景。
本共识梳理了2型炎症性呼吸系统疾病生物制剂治疗的相关证据,对目标人群的确定、治疗起始时机的选择以及药物类型选择方面提供了指导意见。是首个针对中国人群的T2炎症下气道疾病管理共识,将为我国临床工作者提供指导,助力这一系列疾病的诊断和管理。
二、2型炎症性呼吸系统疾病机制与识别
1. 疾病范围
推荐意见1:2型炎症性呼吸系统疾病包括哮喘、部分的慢阻肺病、ABPA、EGPA、嗜酸细胞性支气管炎(eosinophilic bronchitis,EB)、嗜酸性粒细胞性肺炎(eosinophilic pneumonia,EP)和部分的非囊性纤维化支气管扩张症(1D)。
2. 核心病理机制
2型炎症性呼吸系统疾病的主要病理生理特征包括气道上皮屏障功能破坏、炎症细胞浸润、气道黏液高分泌、气道重塑及气道高反应性(airway hyperreactivity, AHR)(表)。T2细胞因子,特别是IL-4、IL-5和IL-13,在上述过程中发挥着关键作用。
表 2型炎症性呼吸系统疾病的共同病理生理特征
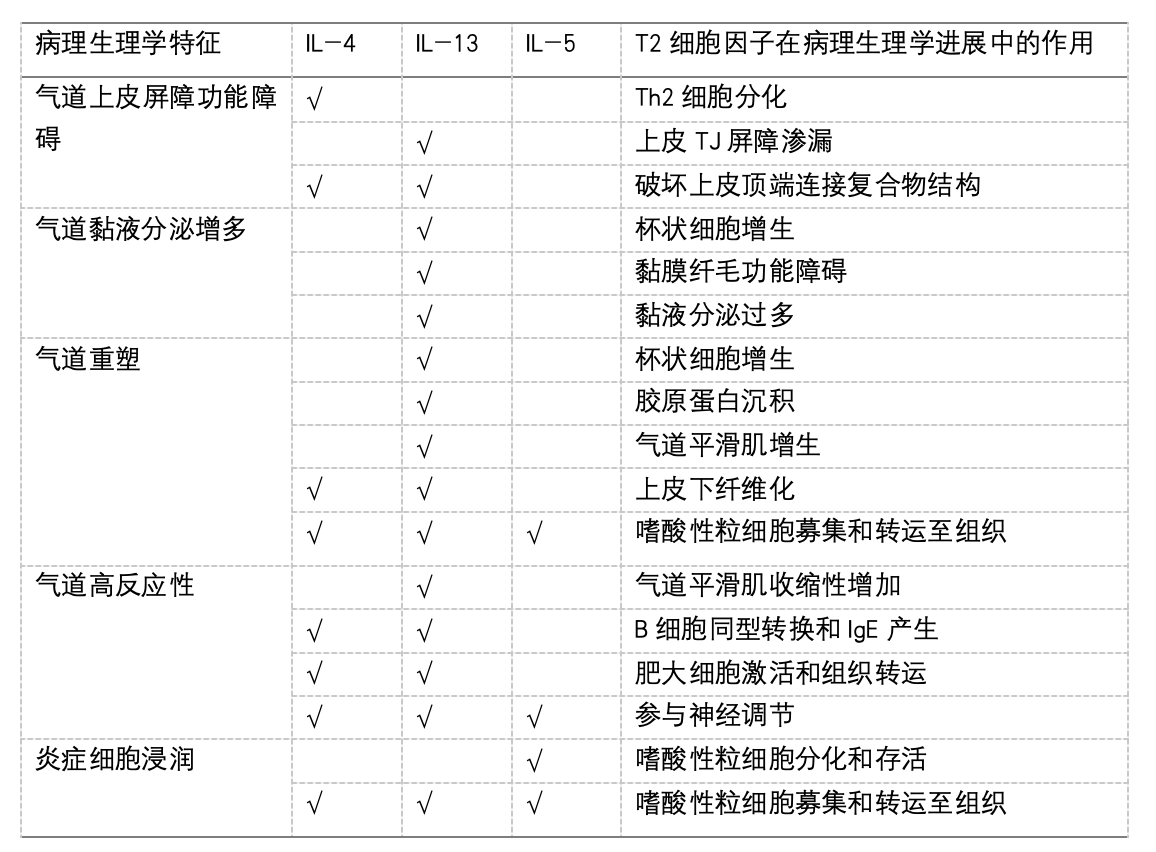
图 2型炎症性呼吸系统疾病机制
IL :白细胞介素;IgE :免疫球蛋白E;Th2,辅助性 2型 T 细胞;TSLP,胸腺基质淋巴细胞生成素
推荐意见2:2型炎症反应主要由Th2细胞和ILC2及其分泌的IL-4、IL-5、IL-13等2型细胞因子介导。其引发的病理生理变化包括气道上皮屏障功能破坏、嗜酸性粒细胞浸润、气道黏液分泌过多、气道重塑和AHR(1D)。
3. 2型炎症识别
目前,呼吸系统疾病临床评估常用的2型炎症生物标志物包括血清总IgE(tIgE)、过敏原特异性IgE(sIgE)、痰EOS、血EOS和呼出气一氧化氮(FeNO)等。虽然全球哮喘防治创议(Global Initiative for Asthma,GINA)对2型炎症性哮喘进行了明确的定义,但对于其他2型炎症性呼吸系统疾病的切值描述尚不统一。但可以明确的是2型炎症生物标志物评估的价值和必要性。
表 不同2型炎症性呼吸系统疾病病理生理与识别
|
|
识别生物标志物 |
主要参与机制 |
2型炎症参与度 |
|
哮喘 |
• FeNO • 血/痰EOS • 过敏原驱动(sIgE) |
• 气道重塑 • 气道高反应 • 黏液分泌 • 气道屏障功能障碍 |
• 56-80%(中国人群,可能低估) |
|
慢阻肺病 |
• 血/痰EOS • FeNO |
• 气道重塑 • 黏液分泌和杯状细胞增生 • 上皮下基质纤维蛋白沉积 • 肺泡破坏 |
• 近30% FeNO水平升高 • 近40%患者存在血EOS升高 |
|
过敏性支气管肺曲霉病(ABPA) |
• sIgE • tIgE • 血EOS |
• 气道黏液嵌塞 • 支气管扩张 • 气道重塑 • 肺纤维化 |
• 2型炎症性疾病 |
|
嗜酸性肉芽肿性多血管炎(EGPA) |
• 血EOS |
• 组织和血管损伤,坏死和纤维化 |
• 2型炎症性疾病 |
|
嗜酸细胞性支气管炎(EB) |
• 痰EOS • FeNO |
• 气道黏液分泌 • 血浆渗出和炎症细胞浸润 |
• 2型炎症性疾病 |
|
嗜酸性粒细胞性肺炎(EP) |
• 血EOS(肺实质或肺泡中大量EOS浸润) |
• 肺内EOS的激活和募集 |
• 2型炎症性疾病 |
|
非囊性纤维化支扩 |
• 血/痰EOS • FeNO • tIgE |
• 支气管壁结构破坏,出现持久性扩张 |
• 30%痰EOS≥3% • 22.6%血EOS水平≥300/μL • 约31%血EOS≥300/μL或FeNO≥25 ppb |
推荐意见3-4:
* 血清tIgE、sIgE、血和痰EOS以及FeNO可用于评估2型炎症,并预测生物制剂的治疗反应。在开始和调整治疗策略之前,均应进行这些指标的检测(1D)。
*血清tIgE和血液嗜酸性粒细胞计数水平升高应排除寄生虫感染和/或其他相关疾病的潜在影响(1C)。
三、靶向治疗的整体原则与核心推荐
1. 治疗原则:个体化分层管理
Step 1:明确T2炎症表型:通过生物标志物(EOS、FeNO、IgE)进行分型。
Step 2:评估疾病严重度(如):
* 哮喘:急性发作频率、OCS使用、ACT评分、肺功能等。
* COPD:年急性加重次数、肺功能、CAT评分等。
Step 3:选择靶向药物:
* IgE通路(奥马珠单抗):过敏性表型优先,可用于哮喘、ABPA等疾病治疗。
* IL-4/IL-13通路(度普利尤单抗):2型炎症表型,FeNO或EOS升高。可用于哮喘,慢阻肺病,慢性鼻窦炎伴鼻息肉或特应性皮炎等疾病治疗。
* IL-5通路(美泊利珠单抗/本瑞利珠单抗):EOS表型(血EOS≥150-300/μL)。可用于哮喘,EGPA,慢性鼻窦炎伴鼻息肉等疾病治疗。
* TSLP通路(特泽利尤单抗):可用于重度哮喘治疗。
Step 4:动态评估与调整:
* 治疗4-6个月后未应答(如急性发作未减少、OCS未减量),需换用其他生物制剂。如应答,应持续治疗直至达到≥12个月的疾病控制。
* 稳定期每4-6月评估疾病、炎症、共病控制情况,调整治疗方案。
2. 核心推荐
推荐意见5-11
* 对于未控制的中重度过敏性哮喘患者,推荐使用抗IgE单抗(奥马珠单抗)作为附加治疗(1A)。
* 对于中重度2型/EOS性哮喘,或需要OCS维持治疗的患者,推荐使用抗IL-4Rα单抗(度普利尤单抗)作为附加治疗(1A)。
* 对于重度EOS性哮喘患者,推荐使用抗IL-5/5Rα单抗(美泊利珠单抗或本瑞利珠单抗) 作为附加治疗(1A)。
* 对于未控制的重度哮喘患者,推荐使用抗TSLP单抗(特泽利尤单抗)作为附加治疗(1A)。
* 对于接受ICS+LABA+LAMA治疗但仍有急性加重风险,且伴有2型炎症(如EOS≥300/μL)的未控制慢阻肺病患者,推荐加用抗IL-4Rα单抗(度普利尤单抗)治疗(1A)。
* 鉴于药物的可用性和可负担性,可将抗IgE单抗(奥马珠单抗)作为ABPA的可选治疗方案(1B)。
* 对于正在接受免疫抑制治疗或正在接受低剂量口服糖皮质激素治疗且出现非重症复发的非重度EGPA患者,推荐添加美泊利珠单抗或本瑞利珠单抗作为联合治疗方案(1B)。
3. 其他疾病的推荐情况 (根据推荐意见12-14整合)
EB/EP及非囊性纤维化支气管扩张的生物制剂治疗目前多为个案报道,RCT证据不足,真实世界研究有限,暂不推荐常规使用。期待未来有更多证据支持。
四、2型炎症性呼吸系统疾病及共病管理
2型炎症性呼吸系统疾病常伴随多种2型炎症相关共病,如哮喘、慢阻肺、鼻窦炎、非甾体抗炎药加重性呼吸道疾病以及特应性皮炎、嗜酸性食管炎等非呼吸系统疾病。共病患者在症状表现、发作频率、住院时间和医疗费用方面均显著高于无共病者,且对口服糖皮质激素的依赖性增加,导致疾病负担加重。对于这些患者,2型炎症的系统性综合管理是能够降低医疗成本,并实现患者控制的有效解决方案。
对于可能存在2型炎症的慢性炎症性疾病患者,需要评估患者2型炎症水平(生物标志物)、同时评估2型炎症共病,疾病控制情况,为患者制定个体化诊疗方案。
除符合生物制剂一般用药指征外,对于中度合并2种2型炎症共病的患者也需考虑2型炎症靶向生物制剂适用性,以帮助患者实现多系统疾病的全面改善。
对于全面评估并调整治疗的患者,包括启用2型炎症靶向生物制剂的患者。在治疗4-6个月后须全面评估患者情况,包括疾病控制是否改善、炎症水平(生物标志物)、共病是否改善。并考虑12个月以上维持改善的治疗目标。
图 2型呼吸系统疾病共病2型炎症性疾病患者的生物制剂策略
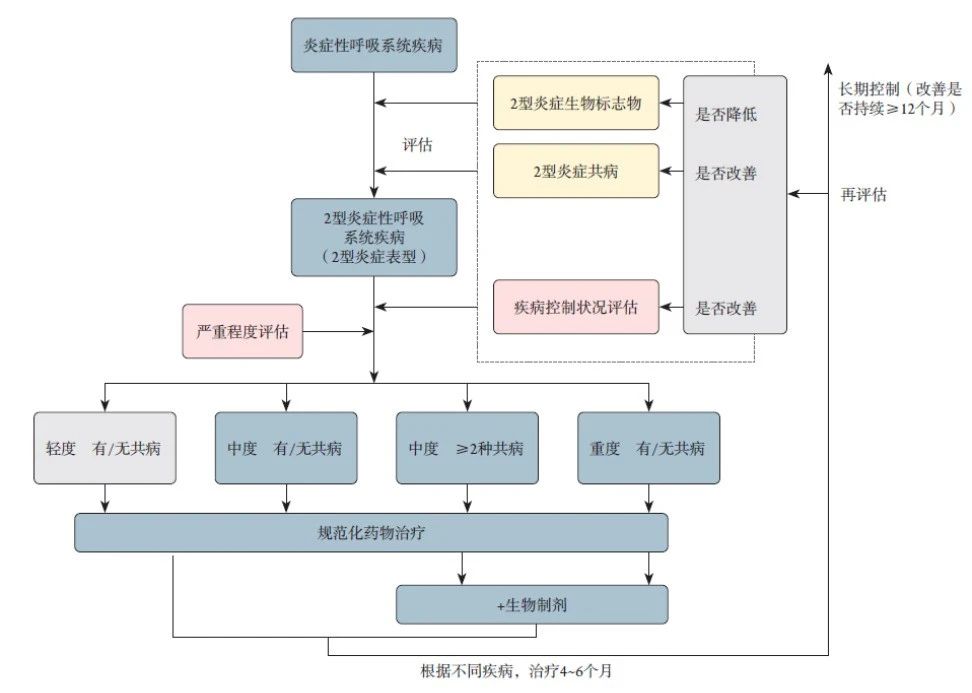
推荐意见15-16
* 在治疗2型炎症性呼吸系统疾病时,建议根据患者的临床表现进行相关共病的多学科评估。评估内容包括评估共病、生物标志物、对生活质量的影响以及现有药物的使用情况(1D)。
* 在选择2型炎症靶向治疗时,初始生物制剂应的首选应聚焦于对生活质量影响最严重的疾病并考虑获批适应症。应在治疗4~6个月后进行生物制剂的疗效评估(1A)。
五、总结
本共识系统整合了T2炎症性呼吸系统疾病的病理机制、诊断标准和治疗策略,通过16条循证推荐为临床实践提供精准指导。共识不仅强化了生物制剂在哮喘、COPD等高证据强度疾病中的应用规范,还针对低证据强度疾病提出审慎管理策略,强调多学科协作与个体化治疗。未来需进一步推动真实世界研究,积累中国人群数据,优化治疗路径,最终实现“炎症早控、共病共管、生活质量提升”的核心目标。
共识编写组
2025年5月
(本文基于《2型炎症性呼吸系统疾病管理:中国专家共识[2024]》核心内容,详细推荐意见及参考文献请查阅原文。Jia, N., Jin, M., Liu, Y., Su, N., Sun, Y., Tang, W., Wang, G., Xie, H., Xie, J., Xie, M., Yao, X., Zhang, H., Chen, R., Liu, C., & Li, J. (2025). The management of type 2 inflammatory respiratory diseases: a Chinese expert consensus [2024]. Journal Of Thoracic Disease, 17(4), 1807-1831. doi:10.21037/jtd-2024-2092)