近日,广州医科大学附属第一医院、广州呼吸健康研究院、呼吸疾病国家重点实验室、国家呼吸系统疾病临床医学研究中心刘明博士团队和华南师范大学马晓冬教授领衔团队经过多年研究,发现了一种肺癌免疫调控的新机制:miR-301a通过靶向Runx3,介导肿瘤抑制免疫微环境,参与肺癌发生发展。
相关研究成果“miR-301a promotes lung tumorigenesis by suppressing Runx3”发表在最新一期国际权威肿瘤学杂志《Molecular Cancer》(影响因子10.679)。呼研院2017级硕士研究生王洁旋为论文共同第一作者,导师刘明博士为共同通讯作者。
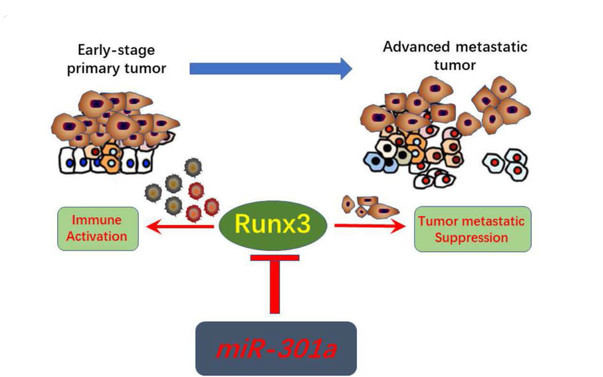
MicroRNAs是一类在细胞生物学中发挥重要调节功能的单链小RNA分子,可以结合靶基因以降低它们的功能。团队前期研究表明,miR-301a的缺失减少了小鼠Kras驱动的肺肿瘤发生,提示miR-301a过表达促进肺肿瘤发生。在NSCLC患者中,miR-301a在肿瘤组织中表达增高,且与分化差和淋巴结转移相关。然而,miR-301a对宿主抗肿瘤免疫的机制仍不清楚。
本研究通过分析KrasLA2和miR-301a- / -;KrasLA2小鼠肺肿瘤组织的转录组学特征,主要包括差异表达基因、生物学功能、信号通路、转录因子和细胞因子等,发现肺肿瘤组织中缺失miR-301a参与并调节B细胞发育,原发性免疫缺陷信号传导,染色体复制的细胞周期控制,T辅助细胞中的iCOS-iCOSL信号传导,T辅助细胞中的CD28信号传导和Th1等信号通路。转录组学的网络信号通路分析发现,IFNG(IFN-γ)和CTNNB1(β-catenin))是miR-301a调节肺肿瘤发生发展最主要的因素。进而实验研究发现,miR-301a的缺失影响肿瘤微环境,miR-301a缺失将CD3+T细胞募集到肿瘤微环境中,从而引起早期肺肿瘤发生中IFN-γ的升高。
进一步的生信分析及生物学实验筛选并验证了Runx3作为miR-301a的靶点,证明了 miR-301a缺失抑制Kras诱导的肺肿瘤发生和发展与Runx3表达的上调和β-catenin的下调有关。进而发现,抑制miR-301a表达可以有效的减少NSCLC细胞系的细胞增殖和迁移,而Runx3表达升高可以逆转这一现象。最后利用WT,miR-301a-/-小鼠和syngeneic mouse models证实, miR-301a的缺失通过升高Runx3和调节T细胞免疫应答来抑制肺肿瘤细胞转移,Runx3的表达的抑制显著地增加了肿瘤肺部转移,同时也减少了CD4+和CD8+T细胞在肿瘤组织中的浸润。
总之,本研究首次发现,miR-301a缺失可通过负向调节靶分子Runx3,增强肿瘤浸润性T细胞的募集,增强机体抗肿瘤免疫反应,进而抑制肺癌的发生发展。该研究提示,miR-301a及Runx3有望成为肺癌免疫治疗的重要靶点。团队后续将围绕该靶点与PD-1/PD-L1抗体及CAR-T细胞治疗相结合,开发新的有效治疗策略,增强肺癌免疫治疗效果。