2025年1月22日,PLOS Neglected Tropical Diseases在线发表了一项由分中心中南大学湘雅医院国家呼吸区域医疗中心潘频华教授研究团队完成的重要研究成果。该研究针对新兴病原体——严重发热伴血小板减少综合征病毒(severe fever with thrombocytopenia syndrome bunyavirus,SFTSV),提出了一种创新性的mRNA疫苗设计策略。这一策略能够为不同基因型的病毒提供交叉保护,并从理论上降低疫苗的潜在副作用。研究团队通过整合免疫信息学、结构生物学和分子动力学等多种前沿方法,不仅降低了疫苗的研发成本,还显著缩短了研发时间,同时提高了疫苗的安全性。这一创新策略使得在新兴病原体被发现时,能够迅速启动疫苗的研制工作,为快速应对新发传染病提供了有力支持。本论文的通讯作者为中南大学湘雅医院的潘频华教授和陈洁副教授。

【研究亮点】
* 开发基于多表位的mRNA疫苗,能同时激活细胞与体液免疫,为SFTSV预防提供新策略。
* 利用多种生物信息学工具对病毒蛋白进行表位预测和筛选,确保疫苗的抗原性、低毒性以及与人类免疫受体的良好结合性。
* 通过分子对接、分子动力学模拟以及免疫模拟等技术,验证了疫苗与免疫受体的结合稳定性、免疫原性以及在人体内的潜在免疫效果。
* 所选表位在多种SFTSV菌株中具有高度保守性,且疫苗设计考虑了不同人群的遗传多样性,有望对不同地区和人群提供广泛的保护。
引言:自2009年首次发现以来,严重发热伴血小板减少综合征病毒(SFTSV)在东亚地区迅速传播,成为一种令人瞩目的虫媒传染病。据统计,2013至2016年间,中国报告了7419例病例,其中355例死亡。由于部分患者未进行高通量测序,实际感染人数可能被低估,许多患者可能被误诊为非典型溶血尿毒综合征。此外,各报告中个体病例数量有限,导致死亡率估计波动较大,不同研究中的死亡率在2%-48%之间。随着报告的增多,真实死亡率可能在5%-10%,并且随着年龄的增长而显著上升。
SFTSV感染引发的病症包括严重发热、血小板减少,常伴有肝功能损害和胃肠道症状。病毒攻击还可能引发细胞因子风暴和弥散性血管内凝血(DIC),最终导致多器官功能障碍。最初,SFTSV被认为仅通过蜱虫传播,但后续研究发现,它还可以通过体液接触甚至气溶胶传播,导致家庭或医院内的聚集性感染病例,也有动物直接传染给人的情况。鉴于其潜在的大流行风险,世界卫生组织在2017年将SFTSV列为最高研究优先级。
尽管对SFTSV的致病过程已有一定了解,但治疗和预防仍面临挑战。目前,人群普遍缺乏对该病毒的特异性免疫力,疫苗开发成为防控SFTSV的关键。现有的SFTSV疫苗研究虽有一定进展,如基于某些载体的疫苗能诱导免疫反应,但整体仍需更有效的疫苗来应对这一公共卫生挑战。
本研究旨在针对SFTSV的高致死风险及现有防治手段不足的问题,开发一种基于多表位mRNA的新型疫苗候选物。通过整合SFTSV的关键结构蛋白(Gn、Gc、NP、NSs)中高度保守的免疫显性表位,结合免疫信息学预测与分子动力学模拟技术,设计能够同时激活体液免疫与细胞免疫的多表位疫苗,以解决传统疫苗开发周期长、覆盖毒株有限及免疫原性不足的局限性,为应对SFTSV潜在大流行提供高效、安全的预防策略。
【研究结果】
表位预测与疫苗构建
通过多种表位预测工具筛选,我们从SFTSV病毒编码蛋白质中获得9个细胞毒性T细胞(Cytotoxic T lymphocyte,CTL)表位、7个辅助T细胞表位(HelperTlymphocyte,HTL)和8个线性B细胞表位,它们均具有良好的抗原性且无毒性和致敏性,其中7个HTL表位还能刺激IFN-γ、IL-2和IL-4的产生。对比分析构建的SFTSV基因组数据库发现,大部分表位在至少170个毒株中保守。接着,使用AAY、GPGPG和KK连接子将CTL、HTL和LBL表位连接,形成由486个氨基酸组成的疫苗蛋白。生物信息学软件预测结果表明,该疫苗抗原性强,且无致敏性和毒性。分析结果进一步表明,该疫苗在哺乳动物红细胞、酵母细胞和大肠杆菌细胞中的半衰期分别超过30小时、20小时和10小时,表明疫苗蛋白稳定且具备亲水性。使用Robetta软件预测并生成三级结构,并经优化后,各项结构质量验证工具提示结构质量良好,设计合理。
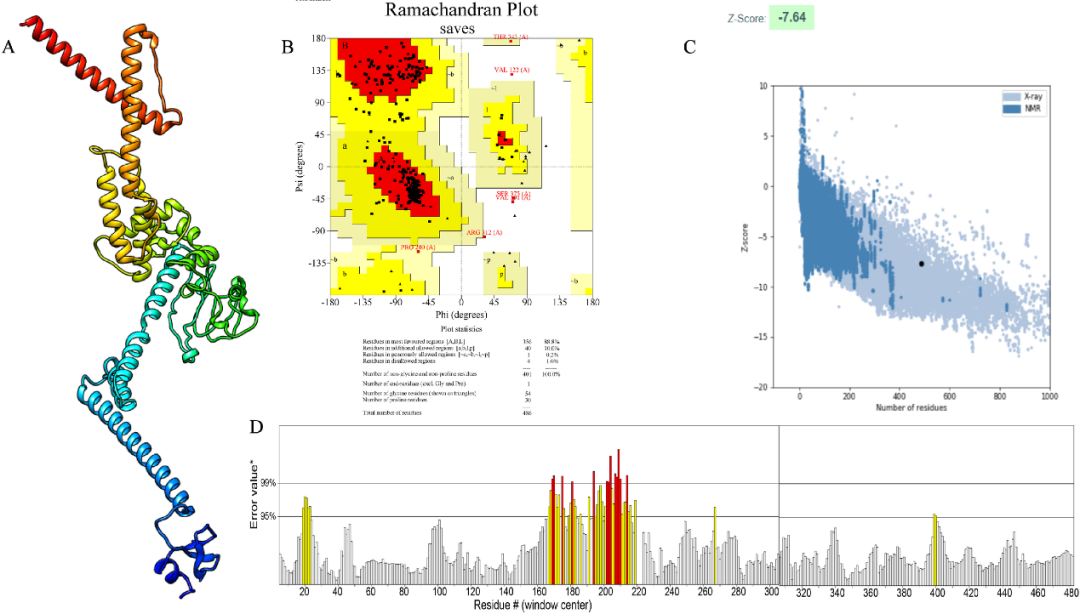
图1.疫苗三级结构预测及评估
分子对接
结合分子对接和分子动力学模拟方法将疫苗,评估疫苗与Toll样受体的结合潜力与结合稳定性。结果表明,我们设计的疫苗可与TLR2和TLR4受体发生稳定结合,这表明设计的疫苗具有刺激免疫接种者先天免疫的潜力。

图2.疫苗与TLR2分子的对接分析(A),疫苗与TLR4分子的对接分析(B)
人口覆盖率和免疫模拟
借助IEDB数据库评估疫苗的人口覆盖率,结果显示该疫苗对全球人口的覆盖率达到99.32%,其中在中国的覆盖率为99.0%,在欧洲为99.93%,在美国为100.0%,在澳大利亚为90.21%。
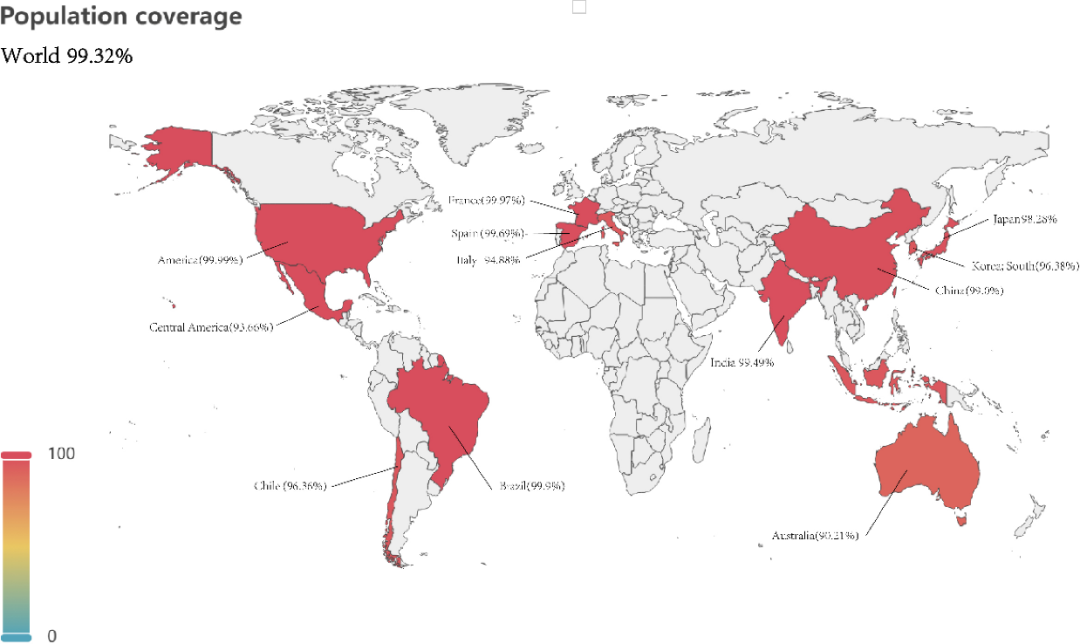
图3.疫苗的人口覆盖率分析
利用C-IMMSIM服务器模拟人体注射疫苗后的免疫反应。在近一年的模拟时间内,经过三次疫苗注射后,抗体水平逐渐升高,峰值接近200000,150天后抗体水平稳定在300000左右。同时,三次疫苗注射能够提高宿主中IL2和IFN-γ等细胞因子的水平。在免疫细胞方面,B细胞和TH细胞的数量在三次疫苗注射过程中呈现先增加后减少并最终达到平衡的趋势;活化的TC细胞数量先增加后减少,而休眠的TC细胞数量则先下降后上升;MA、DC和NK细胞在接种疫苗后数量先上升,随后下降并最终达到相对稳定的状态。这些模拟结果表明,该疫苗能够在宿主体内引发强大的抗体产生,具有产生持久免疫力的潜力,但仍需进一步的实验验证其实际保护效果。
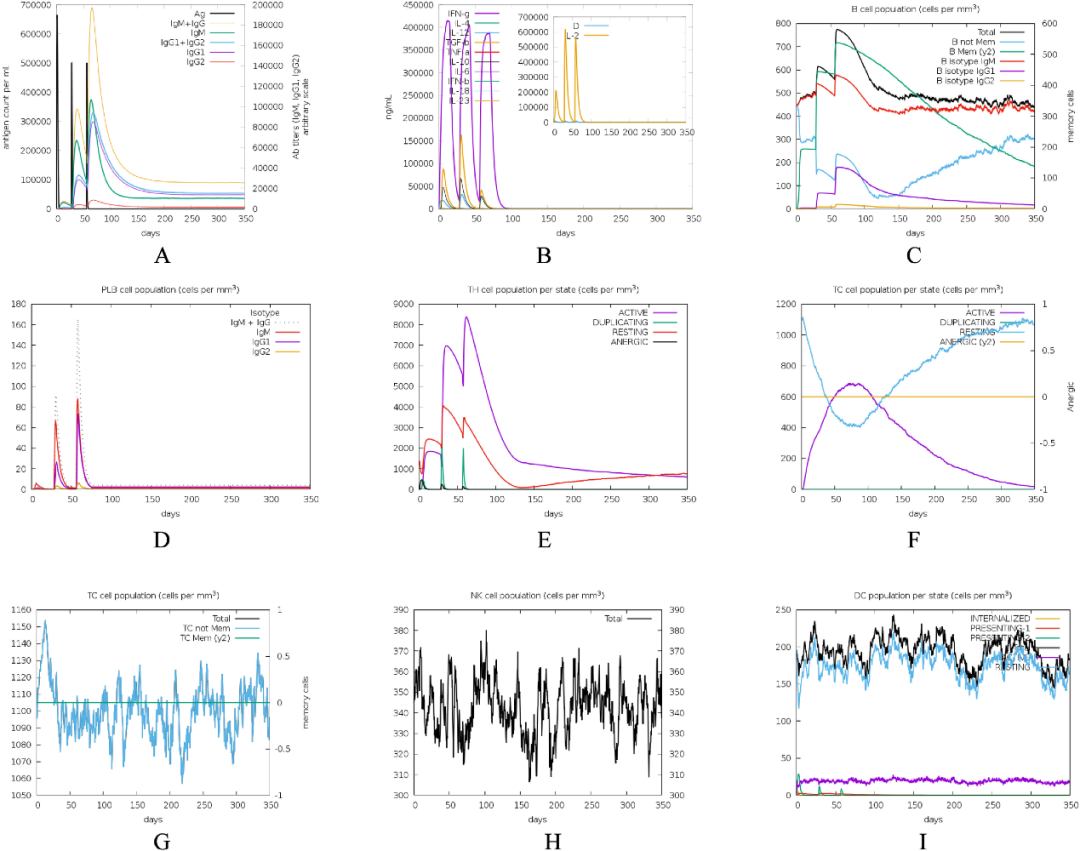
图4.疫苗的免疫模拟分析
多表位mRNA疫苗的构建
相较于基于蛋白的疫苗,mRNA疫苗的免疫原性更强,且具备更强的CTL表位呈递能力。同时我们为进一步增强疫苗免疫原性,我们在疫苗两端分别添加组织型纤溶酶原激活剂的信号肽和MHC-I的跨膜胞内段结构域序列促进疫苗分泌及CTL表位呈递。随后,我们对疫苗序列进行反向翻译,并在疫苗5'端添加了Kozak序列以增强RNA稳定性和提高翻译效率。为稳定mRNA,添加了巨细胞病毒早期基因非翻译区的部分序列作为5' UTR,以及人促生长激素的部分序列作为3' UTR。RNAfold分析显示其热力学集合的自由能为-776.90 kcal/mol,提示mRNA疫苗的二级结构稳定。
【小 结】
本研究基于表位疫苗研发策略设计了表位mRNA疫苗,用于对抗SFTSV。通过免疫信息学方法筛选出强抗原性且安全的多表位构建疫苗,并进行了全面分析。结果显示,疫苗理化性质稳定,抗原性强,无致敏性和毒性;结构预测表明其二级和三级结构合理,模型质量良好;分子对接和动力学模拟表明疫苗能与免疫受体稳定结合,有效引发宿主免疫反应。人口覆盖率和免疫模拟分析发现,疫苗对全球人口覆盖率高,能在宿主体内引发强烈免疫反应,产生高滴度抗体。此外,构建的多表位mRNA疫苗和载体特性优良。总之,该疫苗有望成为预防SFTSV的有效策略,减轻其感染危害,为公共卫生领域应对SFTSV疫情提供有力支持。
【通讯作者】

潘频华 教授
* 医学博士及留美博士后学位
* 博士生导师、博士后导师
* 中南大学湘雅医院呼吸与危重症医学科主任
* 湖南省医学会呼吸病学专业委员会主任委员
* 中华医学会呼吸分会常务委员、呼吸危重症学组副组长及呼吸治疗学组委员
* 擅长呼吸危重症和呼吸衰竭的诊治,以及支气管哮喘和难治性咳嗽的治疗,是湖南最早开展支气管激发试验和舒张试验等技术的专家之一,对呼吸支持技术和ICU感染控制有重要贡献
* 致力于脓毒症和急性呼吸窘迫综合征的临床与基础研究,获得5项国家自然科学基金,发表160余篇论文,主编和参编16部专著,并拥有多项发明专利

陈洁 副教授
* 医学博士及留德博士后学位
* 博士生导师
* 湖南省卫生健康高层次人才
* 中国医药教育协会真菌病分会委员
* 湖南省医学会呼吸病学专业委员会秘书
* 湖南省医学会呼吸病学青年委员会委员
* 主持国家自然科学基金和湖南省重点研发计划等5项课题
* 第一或通讯作者发表SCI论文30篇(IF>1O分3篇,JCR1区23篇,ERJ、Advanced Science等杂志)
* 第一作者获发明专利授权3项,实用新型专利授权9项
* 主攻方向:肺部感染、急性呼吸窘迫综合征和肺癌
【第一作者】

朱飞
* 医学博士
* 中南大学湘雅医院呼吸与危重症医学科医师/助理研究员
* 以第一作者或共同第一作者发表SCI论文10余篇
* 主攻方向:呼吸道病原体感染与预防免疫

马诗旸
* 医学博士,以第一作者或共同第一作者发表SCI论文5余篇