哮喘是一种慢性炎症气道疾病,根据诱导痰中的炎症细胞,哮喘可分为以下四种表型:嗜酸粒细胞型(EA)、混合粒细胞型(MGA)、少粒细胞型(PGA)和中性粒细胞型(NA)(1)。广州医科大学附属第一医院变态反应科李靖教授团队唐海雄博士的前期研究发现MGA患者往往有更高的呼出气一氧化氮(FeNO)水平。与其他炎症表型哮喘相比,MGA患者发展成重度哮喘的风险更高、肺功能更差、小气道功能障碍更明显(2)。一系列同行研究也表明,在各类炎症表型中,MGA患者肺功能最差、症状最严重、医疗费用占比最大(3-4),这表明MGA是最“麻烦”的哮喘类型。因此,阐明MGA气道炎症的分子机制将有助于更好地控制该疾病。
组织蛋白酶S (CTSS)是一种溶酶体蛋白酶,属于半胱氨酸组织蛋白酶家族,可促进细胞内溶酶体途径中受损蛋白的降解(5)。与其他蛋白酶相比,CTSS具有独特的特性,其在各种肺部疾病重发挥了重要作用,包括肺囊性纤维化、COPD和ARDS(5-6)。此外,在OVA诱导的哮喘小鼠模型中,它的表达显著上调(7)。CTSS的单核苷酸多态性也被发现与哮喘风险相关(8-9),这表明它可能参与调控过敏性气道炎症。然而CTSS在MGA发展中的作用及机制尚不清楚。针对这个科学问题,唐海雄博士开展了深入研究。该研究通过检测健康对照及不同炎症表型哮喘诱导痰上清CTSS水平,并分析与临床表现相关性。结果发现,MGA患者诱导痰上清CTSS水平显著升高,且与诱导痰中性粒细胞、FeNO、FEF25-75%及激素用量密切相关。紧接着在动物模型上探索了CTSS促进MGA气道中性粒细胞炎症的机制,为MGA气道炎症的发生机制提供了新的见解。研究结果近期发表在Respiratory Research上。

【研究内容】
收集健康志愿者和哮喘患者的诱导痰上清检测CTSS水平。分别用TDI(甲苯二异氰酸酯)和OVA/CFA建立小鼠MGA模型,并予CTSS抑制剂干预。予重组CTSS刺激小鼠,并通过抑制Akt来探索CTSS诱导MGA气道中性粒细胞炎症的可能机制。
【研究结果】
1、MGA哮喘患者诱导痰CTSS水平升高
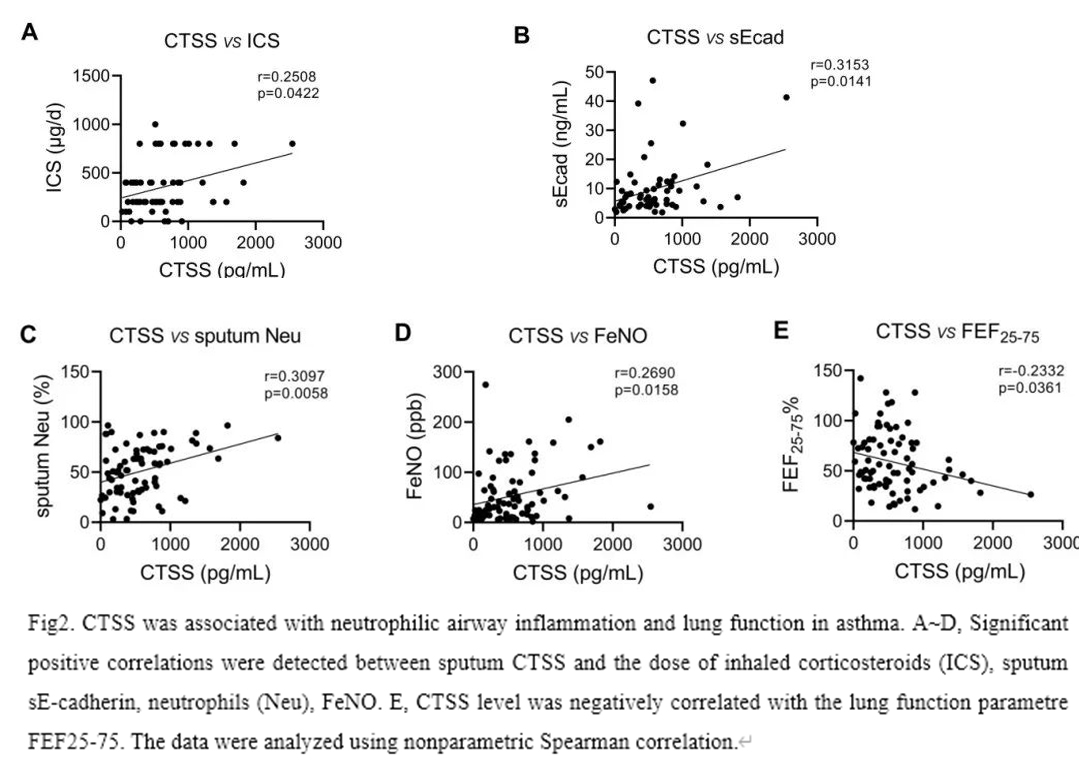
如图1A所示,MGA患者的CTSS表达水平明显高于健康对照组。而其他三种炎症表型哮喘患者的CTSS水平与对照组没有差异,4个表型组间无显著差异。诱导痰中可溶性E-cadherin (sE-cadherin)也有类似的结果(图1,B)。此外,诱导痰中CTSS的水平与每日控制所需吸入激素(ICS)剂量、FeNO、痰中性粒细胞和sE-cadherin水平呈正相关,与FEF25-75呈负相关(图2,A-E)。

2、小鼠MGA模型肺组织CTSS表达上调
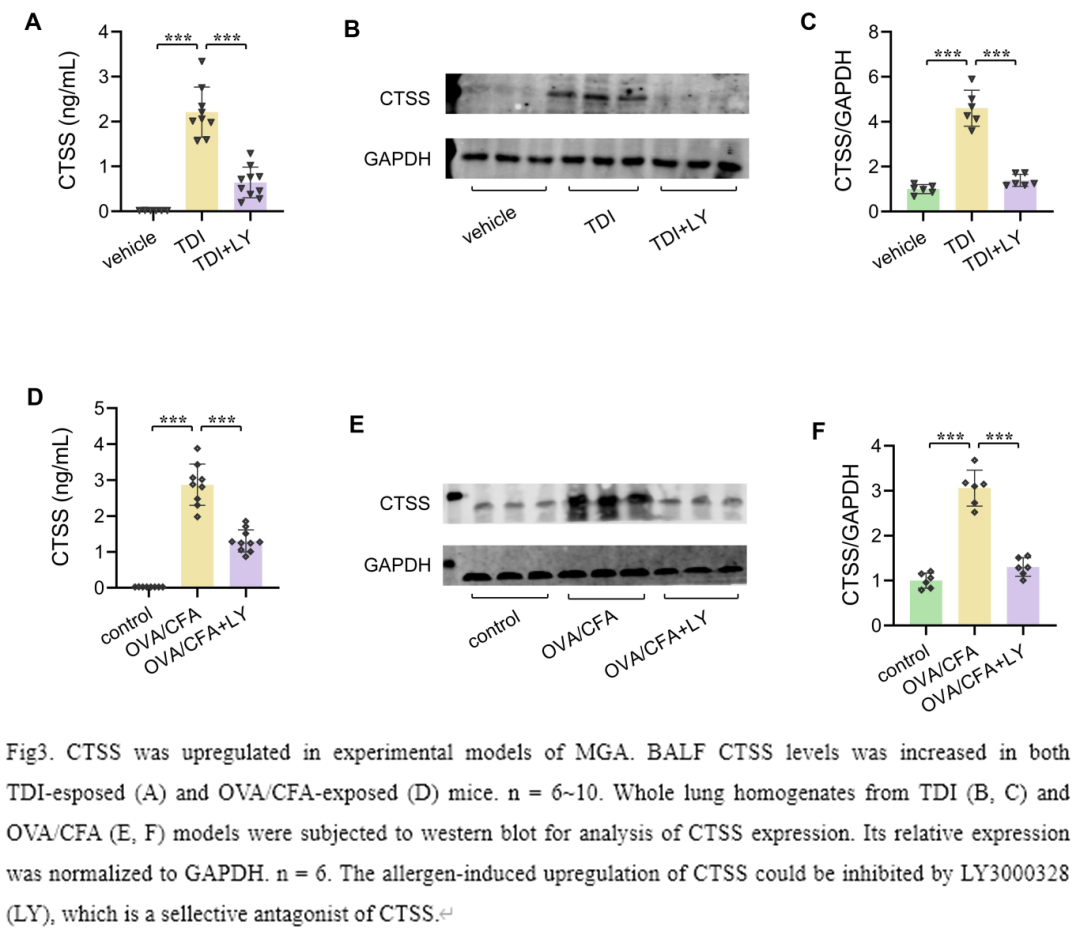
我们分别建立TDI和OVA/CFA诱导的小鼠MGA模型,研究CTSS在MGA中的作用。我们首先在这些小鼠中评估CTSS的表达变化。从图3中可以看出,TDI致敏和激发后,小鼠BALF中CTSS的释放显著增加(图3,A)。TDI组小鼠CTSS总蛋白表达量也高于对照(图3,B-C)。CTSS特异性拮抗剂LY3000328干预后可显著抑制CTSS的表达(图3,A -C)。在OVA/CFA诱导的另一个MGA模型中也发现了类似的结果(图3,D-F)。
3、CTSS抑制剂可减轻TDI诱导的小鼠MGA模型气道炎症
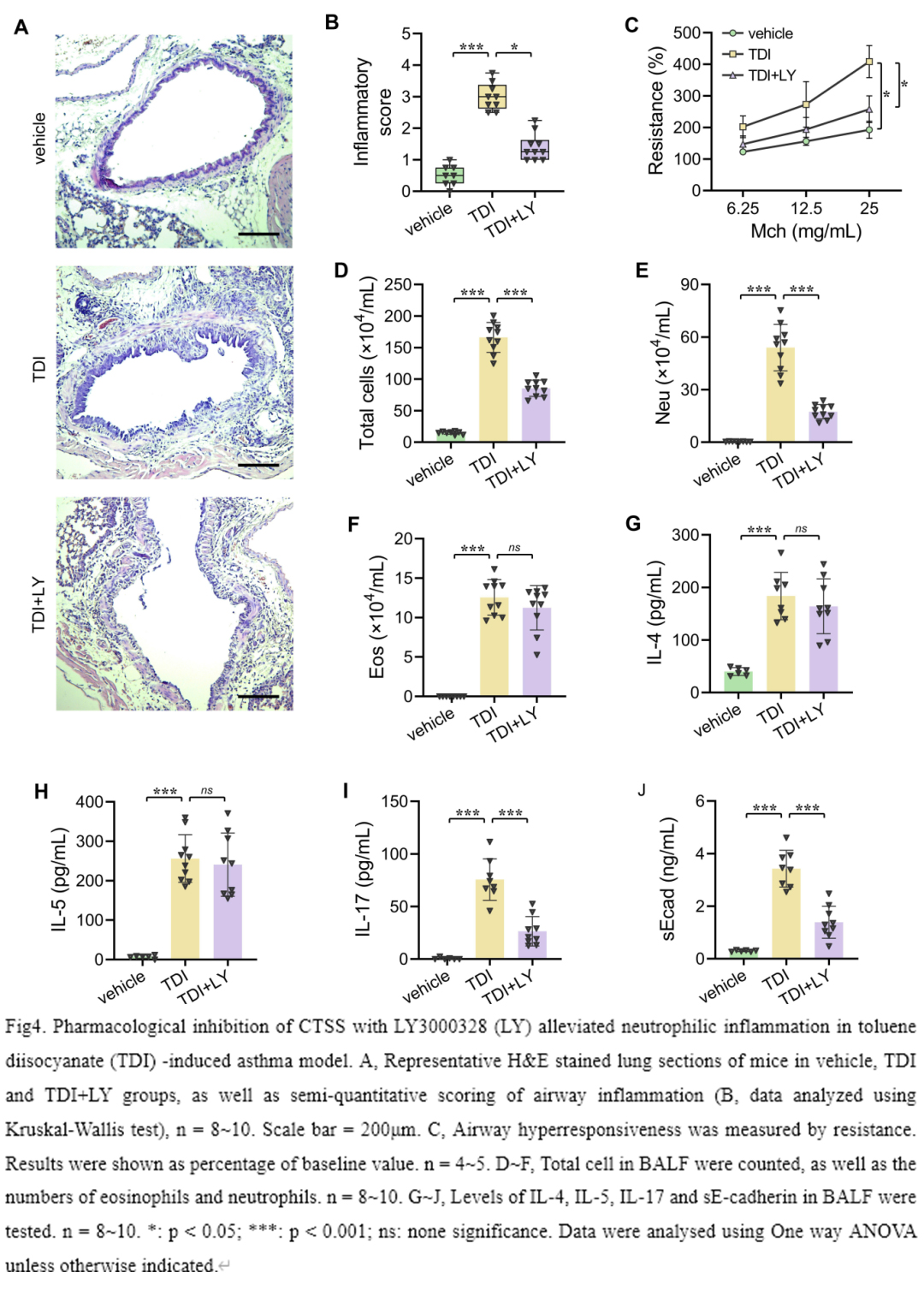
我们评估了CTSS抑制剂LY3000328对TDI诱导的MGA模型气道炎症的作用。TDI致敏及激发后引起小鼠气道中性粒细胞和嗜酸性粒细胞浸润,气道高反应性增加,2型和非2型细胞因子的产生升高(图4)。30mg/kg的 LY3000328可显著减轻TDI诱导的气道高反应性,减少气道管腔内中性粒细胞浸润,降低BALF中IL-17和sE-cadherin的水平。然而,TDI诱导的嗜酸性粒细胞数量以及2型炎症细胞因子IL-4和IL-5的水平并未受到影响(图4)。
4、CTSS抑制剂可减轻OVA/CFA诱导的小鼠MGA模型气道炎症
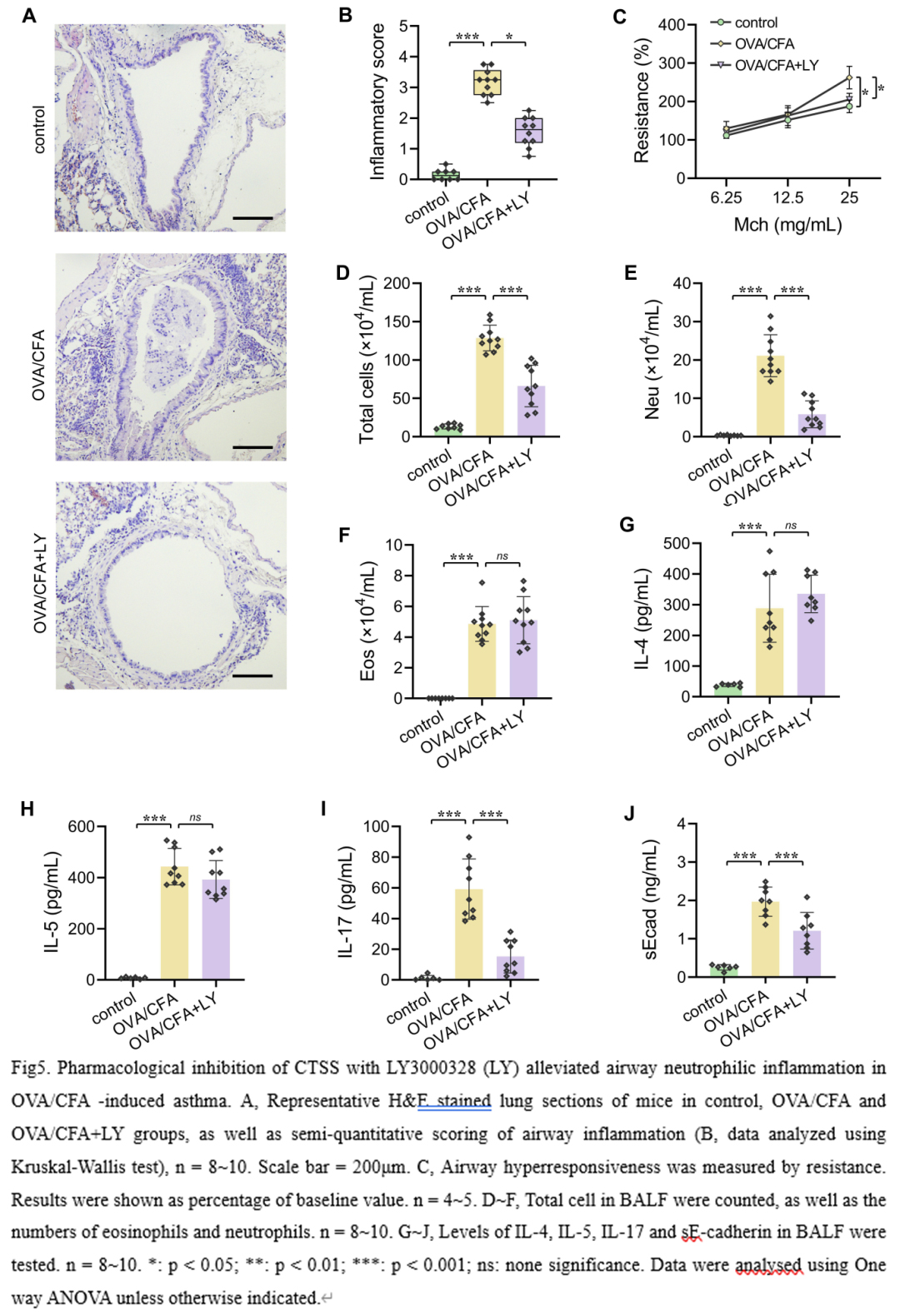
为了进一步证实CTSS在MGA中的作用,我们予OVA联合CFA建立了另一个小鼠MGA模型,该模型也表现为气道内中性粒细胞和嗜酸性粒细胞混合积聚。与TDI模型的结果一致,用30mg/kg LY3000328阻断CTSS也能显著减轻OVA/CFA诱导的气道高反应性和中性粒细胞炎症(图5),但对BALF中嗜酸性粒细胞的数量以及IL-4和IL-5的水平没有影响。以上这些数据表明CTSS参与介导MGA气道中性粒细胞炎症。
5、CTSS通过Akt通路直接诱导气道中性粒细胞炎症
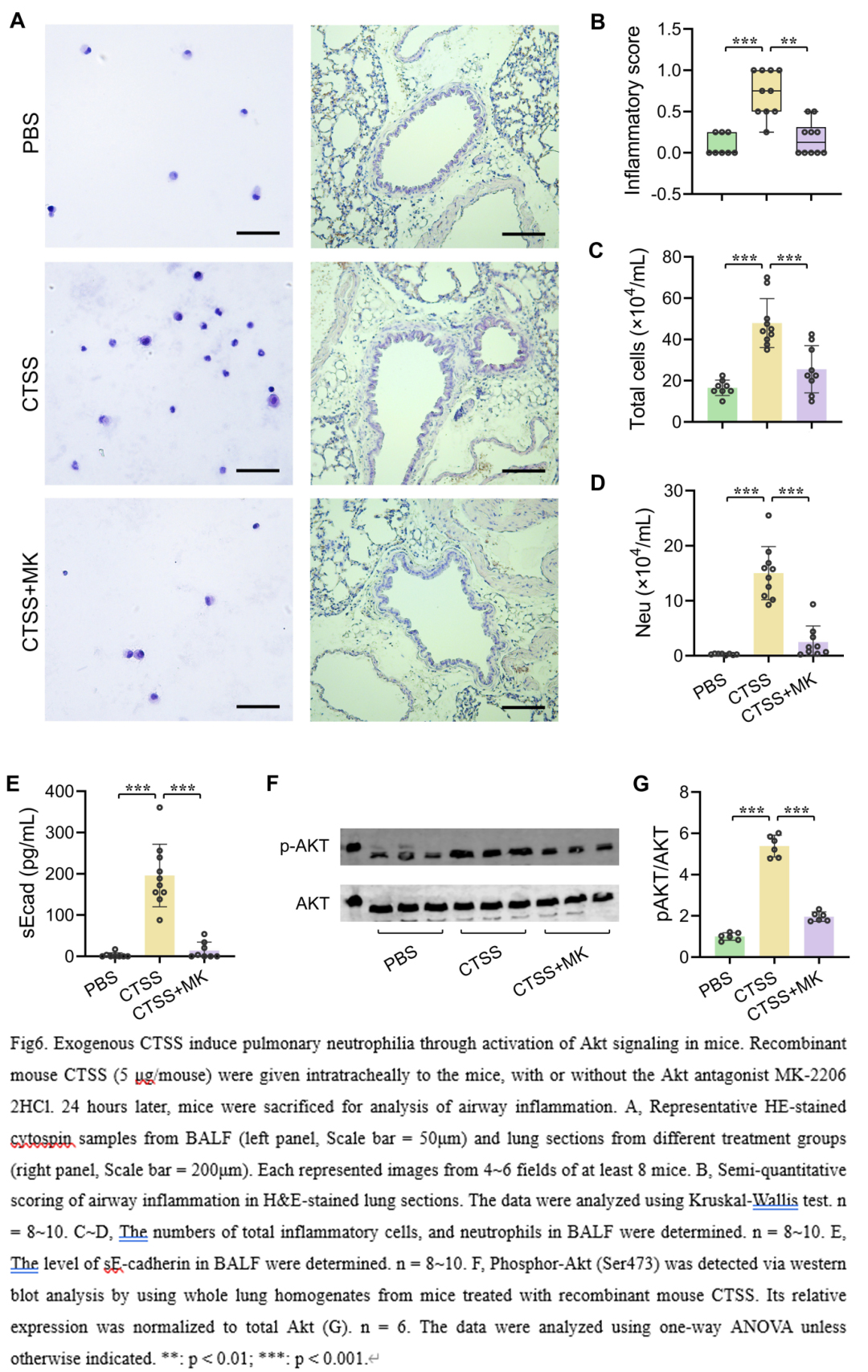
明确CTSS在MGA模型中的促炎作用后,我们下一步试图通过气管内滴注重组小鼠CTSS来研究其直接作用。对照组相比,重组CTSS刺激24小时后,肺内总细胞和中性粒细胞数目显著增加,同时sE-cadherin生成增多(图6,A-E)。而BALF中IL-6、IL-1β、TNF-α水平均低于检测水平。我们前期发现在TDI诱导的MGA模型中Akt通路明显活化(10),而Akt是调节中性粒细胞炎症的重要(11)。Western blot结果也表明,重组CTSS可上调小鼠肺组织磷酸化Akt (Ser473)水平(图6,F和 G),表明CTSS可直接激活Akt。为了验证Akt是否也参与了CTSS诱导的中性粒细胞浸润,我们予MK-2206拮抗Akt。结果显示,MK-2206减轻了CTSS诱导的肺中性粒细胞炎症,同时也减少了BALF中sE-cadherin的释放(图6),这表明CTSS诱导的肺中性粒细胞炎症部分依赖于Akt信号。
【研究结论】
我们的研究数据表明,CTSS参与调控MGA气道中性粒细胞炎症,部分依赖于Akt信号通路,是导致中性粒细胞气道炎症的关键因素。阻断CTSS的作用对混合粒细胞哮喘的治疗有重要的临床意义,该研究为未来哮喘的新药开发提供了更多理论支持。
【通讯作者】

李靖 教授
*广州医科大学附属第一医院、国家呼吸中心、呼吸疾病全国重点实验室
*广州呼吸疾病健康研究院变态反应科主任、教授、博导
*美国Loma Linda大学特聘教授
*世界过敏学会(WAO)成人哮喘委员会委员
*中国医师协会变态反应学分会副会长、中国医促会过敏医学分会副主任委员
*广东省医学会变态反应学分会主任委员、呼吸病学分会哮喘学组副组长
*广州市高层次人才杰出专家、广东省医学领军人才、“岭南英杰工程”第二梯队
*承担多项国家自然基金项目和科技部重大项目
*在Nature Biotechnology、Lancet Respiratory、ERJ、JACI、Allergy、Chest等发表SCI论著140余篇,总影响因子474.263
*获多项国家和广东省科技进步奖
*在过敏性与呼吸道疾病的研究、诊治和预防方面颇具造诣
【第一作者】

唐海雄 博士
*医学博士,南方医科大学珠江医院呼吸与危重症医学科主治医师
*广东省医学会呼吸分会青年委员
*长期从事哮喘和急性肺损伤的基础与临床研究,在ERJ、Allergy、BJP、Am J Respir Cell Mol Biol等杂志发表论文20余篇。
参考文献:
1. Agache I. Severe asthma phenotypes and endotypes. Semin Immunol. 2019 Dec:46:101301.
2. Tang H, Guo Y, Gan S, Chen Z, Dong M, Lin L, Chen H, Ji X, Xian M, Shi X, Tao A, Lv Y, Yao L, Chen R, Li S, Li J. GLUT1 mediates the release of HMGB1 from airway epithelial cells in mixed granulocytic asthma. Biochim Biophys Acta Mol Basis Dis. 2024 Mar;1870(3):167040.
3. Moore WC, Hastie AT, Li X, Li H, Busse WW, Jarjour NN, Wenzel SE, Peters SP, Meyers DA, Bleecker ER; National Heart, Lung, and Blood Institute's Severe Asthma Research Program. Sputum neutrophil counts are associated with more severe asthma phenotypes using cluster analysis. J Allergy Clin Immunol. 2014 Jun;133(6):1557-63.e5.
4. Hastie AT, Mauger DT, Denlinger LC, Coverstone A, Castro M, Erzurum S, Jarjour N, Levy BD, Meyers DA, Moore WC, Phillips BR, Wenzel SE, Fahy JV, Israel E, Bleecker ER. Mixed Sputum Granulocyte Longitudinal Impact on Lung Function in the Severe Asthma Research Program. Am J Respir Crit Care Med. 2021 Apr 1;203(7):882-892.
5. Smyth P, Sasiwachirangkul J, Williams R, Scott CJ. Cathepsin S (CTSS) activity in health and disease - A treasure trove of untapped clinical potential. Mol Aspects Med. 2022 Dec:88:101106.
6. Small DM, Brown RR, Doherty DF, Abladey A, Zhou-Suckow Z, Delaney RJ, Kerrigan L, Dougan CM, Borensztajn KS, Holsinger L, Booth R, Scott CJ, López-Campos G, Elborn JS, Mall MA, Weldon S, Taggart CC. Targeting of cathepsin S reduces cystic fibrosis-like lung disease. Eur Respir J. 2019 Mar 28;53(3):1801523.
7. Fajardo I, Svensson L, Bucht A, Pejler G. Increased levels of hypoxia-sensitive proteins in allergic airway inflammation. Am J Respir Crit Care Med. 2004 Sep 1;170(5):477-84.
8. Li C, Chen Q, Jiang Y, Liu Z. Single nucleotide polymorphisms of cathepsin S and the risks of asthma attack induced by acaroid mites. Int J Clin Exp Med. 2015 Jan 15;8(1):1178-87.
9. Zhou PP, Zhang WY, Li ZF, Chen YR, Kang XC, Jiang YX. Association between SNPs in the promoter region in cathepsin S and risk of asthma in Chinese Han population. Eur Rev Med Pharmacol Sci. 2016 May;20(10):2070-6.
10. Yao L, Zhao H, Tang H, Song J, Dong H, Zou F, Cai S. Phosphatidylinositol 3-Kinase Mediates β-Catenin Dysfunction of Airway Epithelium in a Toluene Diisocyanate-Induced Murine Asthma Model. Toxicol Sci. 2015 Sep;147(1):168-77.
11. Pan T, Sun S, Chen Y, Tian R, Chen E, Tan R, Wang X, Liu Z, Liu J, Qu H. Immune effects of PI3K/Akt/HIF-1alpha-regulated glycolysis in polymorphonuclear neutrophils during sepsis. Crit Care. 2022 Jan 28;26(1):29.