【摘 要】
2023年7月,国际知名学术期刊Clinical and Translational Medicine (IF 10.6, JCR: Q1) 在线发表了广州医科大学附属第一医院、国家呼吸医学中心、国家呼吸系统疾病临床研究中心何建行/梁文华教授团队联合广东技术师范大学卢旭教授团队在肺癌微环境领域的最新研究成果,题为“Cellular dynamics in tumour microenvironment along with lung cancer progression underscore spatial and evolutionary heterogeneity of neutrophil ” (1)的研究。其中,何建行/梁文华教授团队的南山班本科生彭浩欣、吴相荣医生,卢旭教授团队刘少鹏博士为共同第一作者。
研究团队整合多重免疫荧光和单细胞测序分析结果,全面剖析了肺癌进展过程中原发灶和肿瘤引流淋巴结微环境内各细胞类群的含量、空间分布、分子特征和功能变化,揭示了中性粒细胞的空间分布和分化异质性,为理解肿瘤进展及免疫调控机制提供了重要的见解。

【研究背景】
肿瘤转移是肺癌死亡的重要因素,作为抗肿瘤免疫关键枢纽的引流淋巴结(tumor draining lymph node, TDLN)受累是肺癌发生远处转移的早期和关键事件,影响治疗策略并提示预后不良。然而,对于原发灶和TDLN微环境内的各类组分在肿瘤进展过程中的动态演变,及其如何调控肿瘤细胞的侵袭转移等生物学行为,在很大程度上仍属未知。
此前,何建行/梁文华教授团队曾系统探究非小细胞肺癌微环境细胞构成异质性(Front Immunol, 2021, IF 7.3) (2)和空间细胞互作网络(Clin Transl Med, 2023, IF 10.6) (3),揭示了CD8+ T细胞和巨噬细胞等各类细胞类群对预后(Transl Lung Cancer Res, 2022, IF 4.0) (4)及免疫治疗疗效(EClinicalMedicine, 2021, IF 15.1) (5)的预测指示意义,并发现了肺癌TDLN影响原发灶三级淋巴样结构成熟的潜在机制(J Immunother Cancer, 2023, IF 10.9) (6)。在本篇研究中,研究者们在原发灶和TDLN微环境内随肿瘤进展发生动态演变的细胞亚群中关注到了中性粒细胞(neutrophil. neu)独特的免疫调控作用。
【研究队列与分析方法】
1. 纳入553例于2009年至2011年期间在广州医科大学附属第一医院行肺叶切除/亚肺叶切除及淋巴结清扫术的IA~IIIB期非小细胞肺癌患者,结局指标为无病生存期 (disease-free survival, DFS);
2. 采用多重免疫荧光检测技术对原发肿瘤病灶的10种免疫相关靶标,包括CD4、CD38、CD66b、FOXP3、CD20、CD8、PD-L1、CD163、CD68和CD133的数量、密度、百分比及空间位置(包括癌巢与基质)进行检测;
3. 基于StarDist深度学习模型和Delaunay三角剖分算法评估细胞空间分布特征及细胞间互作强度;
4. 采用单细胞测序技术对来自原发肿瘤病灶(4例)和TDLN (8例)微环境内细胞转录特征进行分析;
5. 利用GEO、TCGA和Array-Express等数据库验证所得结果。
【研究结果】
1. 肺癌微环境内细胞构成和空间分布随肿瘤进展而动态变化
(1)从早期(IA~IIA)到中晚期(IIB~IIIB),CD133+肿瘤干细胞和neu浸润显著减少,而M2型巨噬细胞浸润显著增加;
(2)从早期到中晚期,neu与CD4+T细胞、neu与CD38+T细胞、CD4+T细胞与CD38+T细胞间空间分布距离显著延长,提示细胞间互作减弱。

图1. 肺癌微环境内细胞浸润和空间分布图谱随肿瘤进展发生动态变化
2. 浸润细胞类群的预后指示意义随病理分期的进展而变化
(1)在肺癌早期,高浸润水平的CD8+T细胞,无论在癌巢还是基质,均提示较好的预后,而在晚期其预后指示意义并不显著;
(2)癌巢内高浸润水平的调节性T细胞(regulatory T cell, Treg)仅在肺癌晚期提示较差预后;
(3)肺腺癌亚组分析显示,基质内高浸润水平的CD20+B细胞与较长的DFS相关,而癌巢内高浸润水平的巨噬细胞则提示相反结果。
3. Neu展示出独特的受病理分期和空间分布影响的预后指示意义
(1)在肺癌早期,基质内高浸润水平的neu与较长的DFS相关。相反,在肺癌晚期,癌巢内高浸润水平的neu提示较差的预后;
(2)无论分期早晚,neu与主要免疫效应细胞如CD4+T细胞和CD20+B细胞间的空间远隔均与DFS较短的趋势相关。
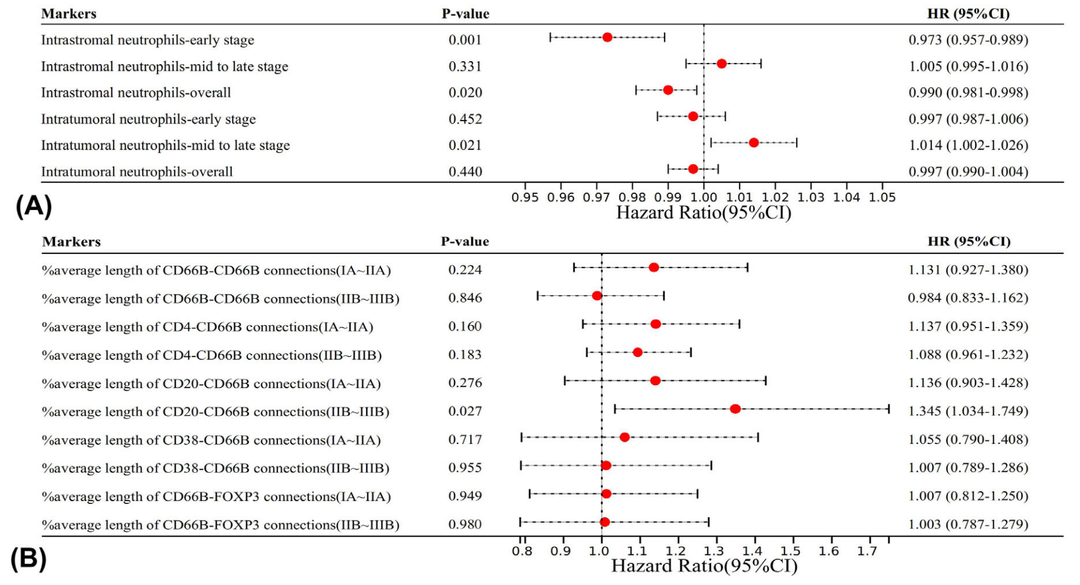
图2. neu病理分期和空间分布依赖的预后效应
4. 干扰素和血管生成相关通路可能是影响neu不同预后效能的驱动因素
(1)标志物表达、通路富集、空间转录组分析均提示在早期肺癌的基质内,neu的抗原提呈和干扰素生成功能活性较高。相反,在晚期肺癌的癌巢内,neu促进血管和淋巴管生成功能活性较高。
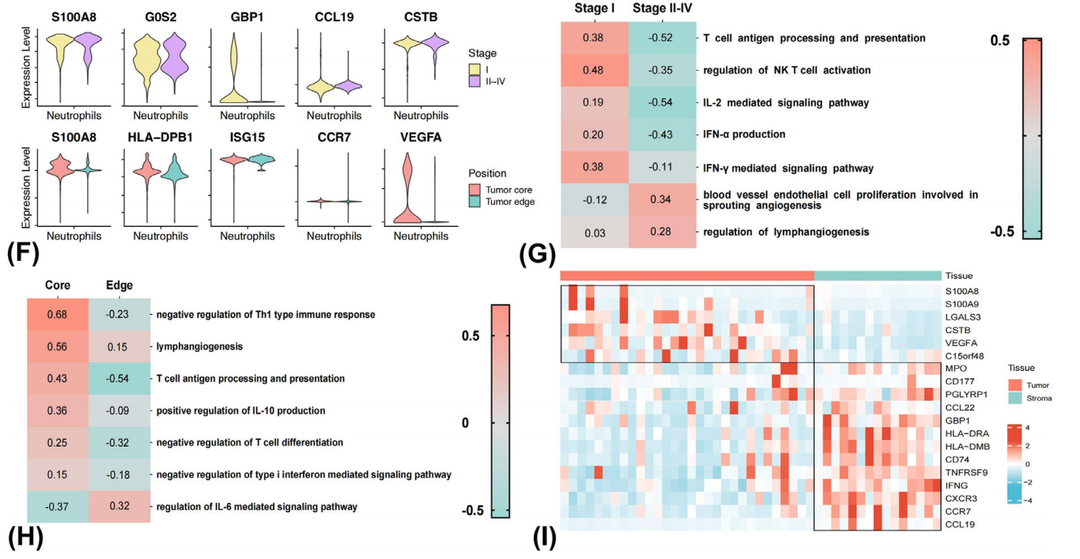
图3. Neu在不同分期和空间分布位置中的功能活性分析
5. 原发肿瘤病灶和淋巴结微环境内的各细胞亚群随肿瘤进展发生显著功能重塑
(1)受肿瘤侵袭TDLN中,Treg的免疫抑制活性增强,树突状细胞的抗原提呈能力减弱而促淋巴管生成能力增强;
(2)在原发肿瘤灶和受肿瘤侵袭TDLN中,辅助性T细胞(T helper-1 cell, Th1)和生发中心B细胞的活性受抑。
6. Neu具有多重功能,并介导差异显著的细胞互作网络
(1)在阳性TDLN中,neu抗肿瘤(抗原提呈)和促肿瘤(血管生成、免疫抑制)功能活性均较高;
(2)在阳性TDLN中,neu与巨噬细胞和内皮细胞密切互作,参与上皮间质转化和血管生成通路的靶基因表达显著上调;
(3)在阴性TDLN中,neu与Th1和细胞毒性T细胞密切互作。
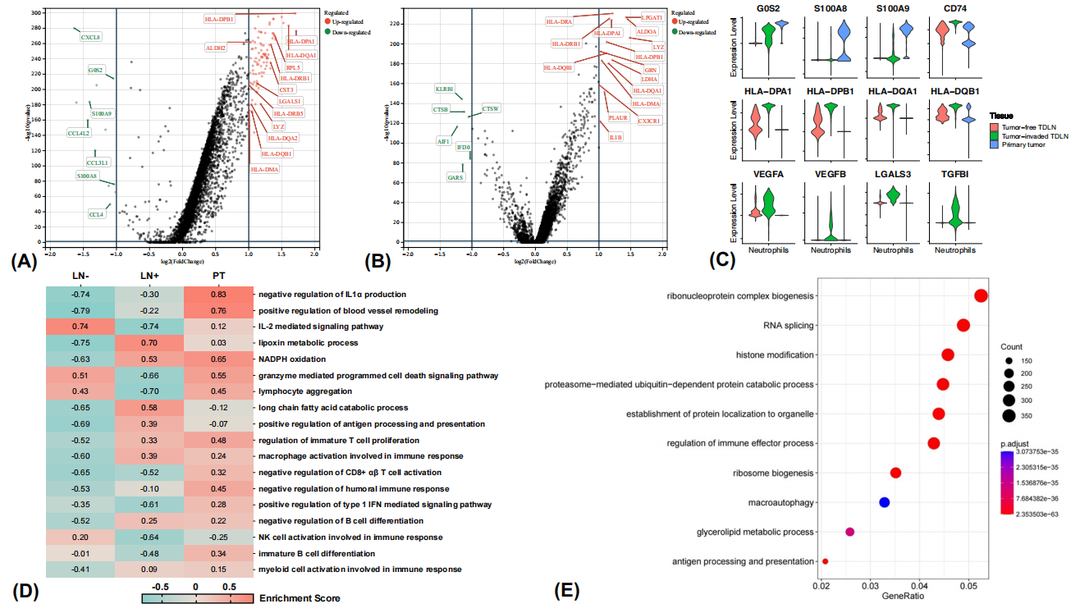
图4. Neu在原发灶和TDLN微环境内转录谱和功能活性显著不同

图5. Neu在阳性/阴性TDLN中介导差异显著的细胞互作网络
7. 在阳性TDLN内,Neu由异质性的亚群组成
(1)依据转录特征和功能活性差异,阳性TDLN内的neu亚群大致可分为以下5类:TAN-0具有抗原提呈功能;TAN-1高表达干扰素相关基因;TAN-2促血管生成;TAN-3为经典亚群;TAN-4具有促炎功能;
(2)拟时序分析结果表明,neu的分化轨迹从TAN-1开始,通过TAN-3和TAN-4作为过渡状态,最终达到TAN-2这一终末分化状态,TAN-0的特征沿着拟时间轨迹保持;
(3)TAN-1、TAN-2、TAN-3分别为在原发灶、阳性和阴性淋巴结微环境内主导的neu细胞亚群。随病理分期进展,原发灶内TAN-2亚群占比显著增加。
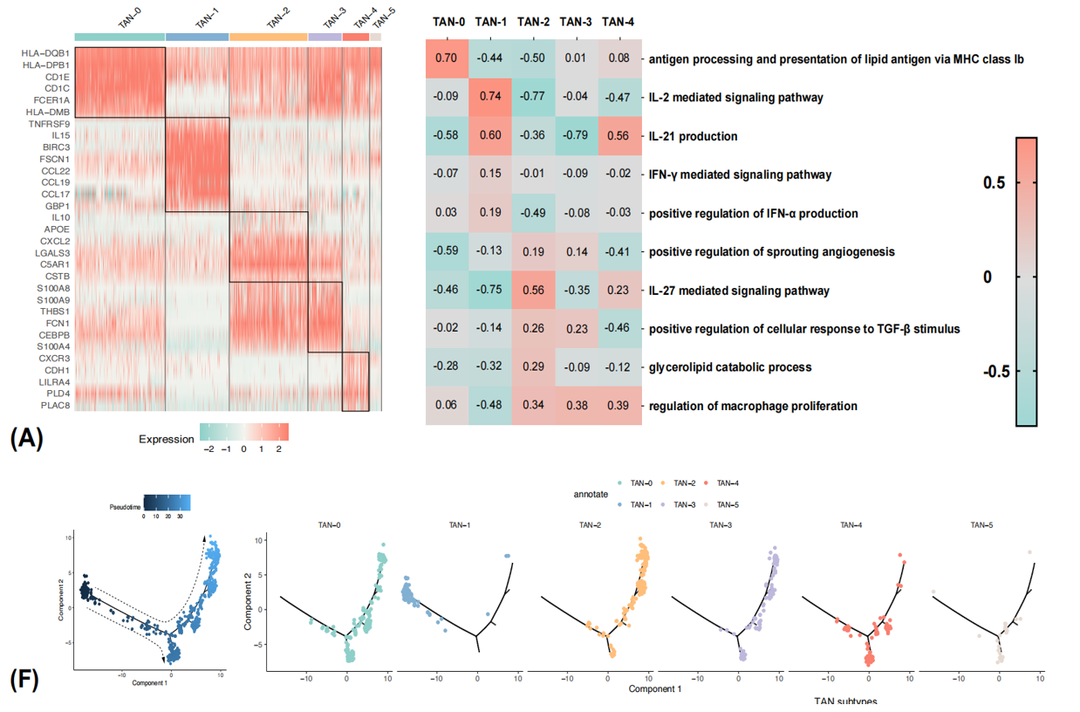
图6. Neu在阳性TDLN中转录谱、功能活性和拟时序分析
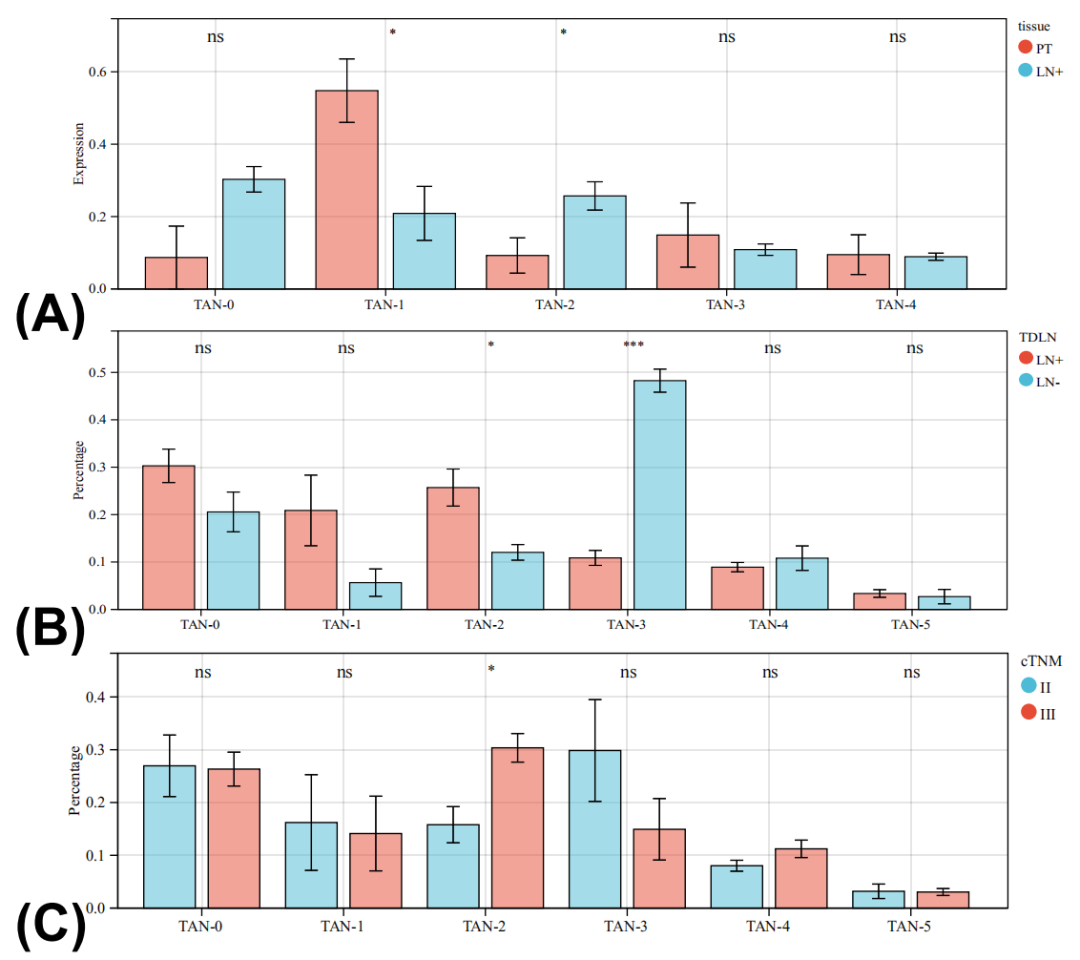
图7. Neu亚群在不同空间分布及病理分期的含量变化
8. Neu在原发灶和TDLN微环境内的浸润和分化模式示意图
(1)TAN-1在原发肿瘤间质中含量丰富,而TAN-2在癌巢中含量丰富。阴性TDLN中TAN-3为主要的neu亚型,而在阳性TDLN中TAN-2为主要的neu亚型。Neu的分化轨迹从TAN-1开始,通过TAN-3和TAN-4作为过渡状态,最终达到TAN-2这一终末分化状态。

图8. Neu在原发灶和TDLN微环境内的浸润和分化模式示意图
9. Neu的分化相关基因具有预后和免疫治疗疗效预测指示意义
(1)CTSZ, NME2, NPM1, EIF3E, PPIA和PLAUR是neu分化过程中具有稳健预后指示意义的基因,并以此构建预后模型(neutrophil differentiation expression gene score, NDEGS)
(2)高/低NDEGS评分组的预后、基因突变和免疫浸润图谱存在显著差异
(3)低NDEGS评分组免疫相关基因突变率较高,免疫效应细胞浸润较多,高TMB人群占比较多,提示该组人群更容易从免疫治疗中获益

图9. 构建具有预后和免疫治疗疗效指示意义的neu分化相关基因模型
【总结与展望】
来自何建行/梁文华团队的系列研究,对肺癌微环境内起免疫调控作用的重要组分进行了系统剖析,揭示了原发灶和TDLN微环境内肿瘤相关中性粒细胞这一协调固有免疫和适应性免疫应答重要一员的构成异质性、表型可塑性和功能多样性,为理解肺癌演化过程提供重要参考。研究团队计划进一步探究肿瘤相关中性粒细胞促/抗肿瘤的具体分子机制,为靶向和利用其相关亚群的新疗法提供帮助。
【作者简介】






【参考文献】
1. Peng H, Wu X, Liu S, He M, Tang C, Wen Y, et al. Cellular dynamics in tumour microenvironment along with lung cancer progression underscore spatial and evolutionary heterogeneity of neutrophil. Clin Transl Med. 2023;13(7):e1340.
2. Peng H, Wu X, Zhong R, Yu T, Cai X, Liu J, et al. Profiling Tumor Immune Microenvironment of Non-Small Cell Lung Cancer Using Multiplex Immunofluorescence. Front Immunol. 2021;12:750046.
3. Peng H, Wu X, Liu S, He M, Xie C, Zhong R, et al. Multiplex immunofluorescence and single-cell transcriptomic profiling reveal the spatial cell interaction networks in the non-small cell lung cancer microenvironment. Clin Transl Med. 2023;13(1):e1155.
4. Wu X-R, Peng H-X, He M, Zhong R, Liu J, Wen Y-K, et al. Macrophages-based immune-related risk score model for relapse prediction in stage I-III non-small cell lung cancer assessed by multiplex immunofluorescence. Transl Lung Cancer Res. 2022;11(4):523-42.
5. Li F, Li C, Cai X, Xie Z, Zhou L, Cheng B, et al. The association between CD8+ tumor-infiltrating lymphocytes and the clinical outcome of cancer immunotherapy: A systematic review and meta-analysis. EClinicalMedicine. 2021;41:101134.
6. He M, He Q, Cai X, Liu J, Deng H, Li F, et al. Intratumoral tertiary lymphoid structure (TLS) maturation is influenced by draining lymph nodes of lung cancer. J Immunother Cancer. 2023;11(4).
(转自:南山呼吸)