【病史】
患者为中年女性,主诉反复咳嗽2年余,加重伴发热10余天。外院查胸部CT提示右上肺囊实性团片状影。既往病史无特殊。
【影像学检查】
完善胸部CT平扫+增强检查:右上肺见囊实性团片状影,大小约48×34mm。
完善全身PET/CT检查:
1、右上肺支气管开口处高代谢结节,伴右上肺尖段-前段混杂密度灶伴囊腔形成,囊壁代谢环形增高,考虑右肺上叶肺癌跨肺裂累及右肺中叶。
2、右肺门淋巴结转移。
3、左侧锁骨上3个高代谢淋巴结,考虑转移瘤。
4、肝S8高代谢结节(2处),考虑为转移瘤。
完善头颅MR:未见转移灶。
【病理及基因检测】
病理结果:提示肺腺癌,免疫组化:CK(+),TTF1(+),NapsinA(+),P40(-),P63(-),Ki67(约10%+), PD-L1(E1L3N)(约30%+),PD-L1(Neg)。
基因检测结果:EGFR 19del 合并 TP53突变
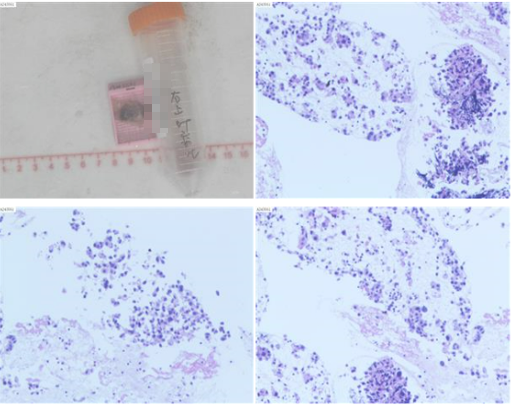
目前诊断:右上肺浸润性腺癌伴多发淋巴结、肝转移(cT2N3M1c1,ⅣB期)
【病例难点与文献回顾】
针对本例携带EGFR/TP53共突变,伴肝转移的晚期非小细胞肺癌(NSCLC)患者,广州医科大学附属第一医院张鑫教授团队陈学炜医生对现有文献进行了深入回顾与分析,汇报了此类患者治疗选择中的难点与可能的解决方案。
1. EGFR共突变:复杂基因背景下的不良预后
EGFR突变患者中,约30%-40%同时携带TP53突变。研究表明,相比于EGFR-TKIs单药治疗,EGFR-TKIs联合化疗在EGFR/TP53基因共突变的晚期NSCLC患者中能够改善客观缓解率(ORR)和中位无进展生存期(PFS)[1]。
2. 肝转移:预后较差的转移部位
肝转移在NSCLC患者中的发生率约为15%-20%,其预后显著差于其他转移部位,中位OS仅约3个月[2,3]。既往研究指出,肺癌肝转移患者对全身化疗的敏感性较低,化疗有效PFS、OS较无肝转移患者更短[4]。
3. 联合治疗:改善肝转移患者的生存结局
尽管传统治疗效果有限,抗血管生成治疗在肺癌伴肝转移患者中显示出一定疗效[5]。
4. 新辅助免疫治疗:驱动基因阳性患者的新希望
一项国内多中心回顾性研究纳入了40例驱动基因阳性NSCLC患者,其中47.5%(19/40)携带EGFR突变,主要探索了免疫新辅助治疗在驱动基因阳性NSCLC患者中的临床疗效[6]。
*部分缓解率(PR):62.5%(25/40)
*N2降期率:60.0%(9/15)
*手术R0切除率:仅1例为R2切除,其余均为R0切除
*病理缓解:37.5%的患者达到主要病理缓解(MPR),12.5%达到病理完全缓解(pCR)。
研究还发现,尽管PD-L1表达与疗效无显著相关性,高表达患者可能从新辅助免疫治疗中获益更多。免疫联合化疗(IO+CT)新辅助治疗模式可能在驱动基因阳性患者中具有更高的治愈潜力和长期生存获益。
【治疗选择与疗效评价】
1. 治疗选择:
经过院际MDT讨论和文献回顾学习,该患者最后进行了化免+靶向+抗血管治疗,具体方案为培美曲塞+卡铂+帕博利珠单抗+阿美替尼+贝伐珠单抗(第1疗程无联用贝伐珠单抗)。
2. 疗效评价:
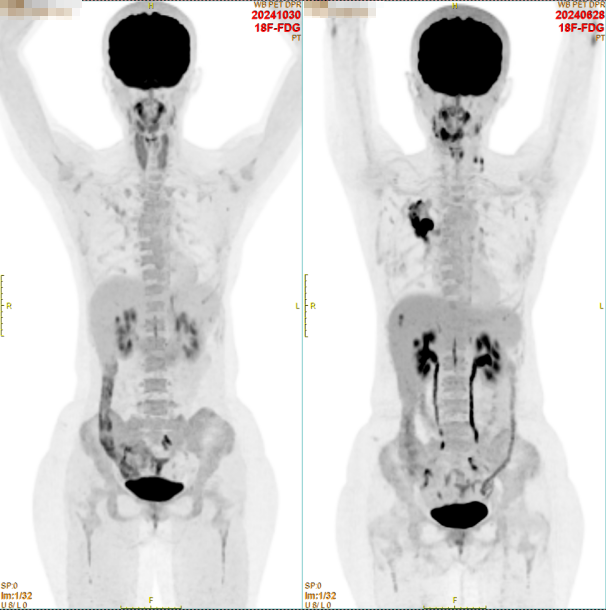
4个疗程后复查全身PET/CT,结果提示:
①原右上肺癌灶,体积较前缩小,代谢较前明显降低。
②原右肺门及左侧锁骨上高代谢淋巴结现代谢降至本底水平。
③原肝S8高代谢结节,现未见显示。
3.不良反应:
治疗期间患者出现药物性甲状腺功能亢进不良反应,指导患者进行内分泌科门诊随访及抗甲亢药物治疗。末次复查甲状腺功能,基本达到正常水平。
【围手术期呼吸康复训练】
结合患者的手术意愿,治疗期间请院内呼吸内科予以围手术期呼吸康复训练,复测肺通气功能提示中度限制性肺通气功能障碍(1.92L,占预测值69%)。最大分钟通气量(MVV)在正常范围 (91L/min)。复测肺弥散功能提示弥散功能在正常范围。完善6分钟步行试验提示预计步行距离为655.78米,步行距离 540米,占预计值:82.34%。
对患者进行肺灌注显像联合肺功能测定预测肺癌术后肺功能,结果提示:
①右上肺灌注功能受损灶,结合同机CT,考虑为肺癌(治疗后)所致。
②分肺灌注功能的测定:右肺占全肺的48%;左肺占全肺的52%。
③右肺血流灌注功能分布:上肺(8%),中肺(9%),下肺(31%),共计 48%。
④左肺血流灌注功能分布:上肺(23%),下肺(29%),共计52%。
【MDT讨论】
后续治疗方案的选择
1、降期后手术
2、原方案维持
3、适应性治疗(减药:单靶向?化免联合?)
4、放疗
【文献回顾与治疗进展:新辅助治疗与术后策略探索】
1、化免+抗血管生成治疗方案:肺癌新辅助与术后辅助治疗的安全有效选择
一项最新研究评估了信迪利单抗联合安罗替尼和化疗的新辅助治疗在可切除NSCLC中的疗效与安全性。研究纳入45例ⅡA-ⅢB期患者,术前接受三周期联合治疗,末次治疗后4-6周内进行手术治疗,术后以信迪利单抗单药维持1年。其中41例患者完成手术。结果显示,病理完全缓解(pCR)达57.8%,主要病理缓解(MPR)为66.7%,客观缓解率(ORR)为71.1%。尽管新辅助治疗阶段3-4级不良事件发生率为55.6%,未见5级不良事件,表明该方案安全可行[7]。
2、EGFR突变肺癌术前新辅助治疗:免疫联合化疗可见成效
一项开放标签、单中心Ⅱ期研究针对Ⅱ~ⅢB期(N1-N2)EGFR突变的NSCLC患者,评估信迪利单抗联合化疗的新辅助治疗效果。患者接受3个周期的信迪利单抗加化疗后进行手术,主要研究终点为主要病理反应(MPR)。初步研究结果显示:客观缓解率(ORR)高达75%(15/20),N分期降期率为55%。更为显著的是,有1例患者(5%)获得病理完全缓解(pCR),9例患者(45%)达到了MPR。值得关注的是,PDOs体外药敏研究表明,在新辅助免疫治疗+化疗前后观察到类似的基因组改变,这些改变并未影响后续EGFR-TKls的疗效[8]。
3、EGFR阳性晚期非小细胞肺癌治疗进展后:免疫联合疗法延长无进展生存期
本中心一项最新研究通过网状META分析评估了EGFR突变阳性晚期非小细胞肺癌EGFR-TKI治疗进展后免疫检查点抑制剂的疗效与安全性。结果显示,与免疫单药相比,化疗联合免疫(化免)和化免+抗血管生成均延长了无进展生存期。Network MA显示,化免+抗血管方案在无进展生存期方面表现最佳,但也伴随更高的任何级别和3级或以上不良事件的风险[9]。
4、免疫新辅助治疗后开展手术的安全性
一项回顾性研究分析了31名初始评估为不可切除的肿瘤患者在接受免疫治疗后肿瘤明显退缩,后续接受了手术治疗。所有患者均在术后恢复良好,未出现严重并发症。病理分析显示,有12名患者实现了至少MPR级别的病理缓解,并有15例出现了病理降级[10]。
国外一项研究表明,与免疫检查点抑制剂相比,EGFR-TKI新辅助治疗的 MPR 和 pCR 率的结果更差,pCR率为0–12%,MPR率为8-24%[11]。
5、免疫联合化疗新辅助治疗后开展手术的疗效
本中心一项研究表明,在接受免疫联合化疗新辅助治疗降期后进行手术的患者,与未手术但治疗有反应组和未手术且治疗无反应组相比,手术组患者生存期最长,中位无疾病生存时间达到27.5月,显著高于其他患者[12]。接受3-4次新辅助治疗的患者,更容易在治疗后实现MPR级别的病理缓解[13]。
【专家点评】
广州医科大学附属第一医院病理科赵主任对病理切片进行判读,镜下观察到肿瘤组织呈条索状和实性结构,肿瘤细胞核形态不规则或圆形,胞浆丰富,核分裂少,提示可能为肺源性非小细胞癌。进一步免疫组化染色检测结果显示:肺腺癌标记物TTF-1和NapsinA均为阳性,而肺鳞癌标记物P40和P63均为阴性。结合镜下形态学表现和免疫组化结果,最终诊断为肺腺癌。
广州医科大学附属第一医院肿瘤内科谢展鸿主任指出,该患者被诊断为IV期肺腺癌,经过化免联合靶向及抗血管治疗后,复查PET-CT显示原发灶和转移灶的代谢显著减弱,表明治疗取得了良好疗效。影像学检查显示病灶呈囊性病变,考虑到囊性病变在腺癌中的发展与复发较快,谢主任建议在新辅助治疗后对患者的母病灶进行切除。关于免疫治疗在驱动基因阳性肺癌患者中的应用,谢主任提到免疫治疗联合靶向治疗在这些患者中可能效果不佳,尤其是对于ALK抑制剂的使用,可能带来较明显的不良反应,如肝功能损害和肺间质改变等。依据临床治疗指南,驱动基因阳性患者的首选一线治疗为靶向治疗。对于该患者,术后可以继续使用靶向治疗,并通过微小残留病灶(MRD)动态监测来评估是否需要调整治疗策略。
广州医科大学附属第一医院胸外科邵文龙主任认为,对于晚期肿瘤患者,经过转化治疗后,外科干预的需求日益增加。国内外在这一领域进行了多种尝试,并积累了成功的经验。外科干预形式包括局部切除、根治性手术等。从整体来看,转化治疗后实施外科干预对患者整体生存是有获益的,因此建议在条件允许的情况下积极进行手术切除。
广州医科大学附属第一医院胸外科崔飞主任提出,传统上,EGFR阳性的肺癌患者通常首选EGFR-TKI治疗,但这一理念正面临一些新的挑战。本中心一项针对双阳性(EGFR阳性和PD-L1阳性)局部晚期肺癌患者的新辅助治疗临床研究显示,初步结果表明新辅助免疫治疗的病理完全缓解(pCR)率显著高于EGFR-TKI靶向治疗。对于双阳性患者,未来需要更多的临床试验,以优化治疗策略和分层指导。需要注意的是,免疫联合靶向治疗可能使免疫相关副作用的风险提高至3倍。为降低术后免疫相关副作用的发生率,建议通过多学科讨论(MDT)制定术后治疗方案。此外,对于病理达到pCR的患者,仍建议术后辅助治疗,以进一步降低术后复发和转移的风险,同时术后进行微小残留病灶(MRD)检测也尤为必要。
最后国家呼吸医学中心中日友好医院梁朝阳教授对本次病例MDT进行小结,他提出随着靶向治疗和免疫治疗的不断进展,越来越多的晚期肺癌患者接受转化治疗。在处理残存病灶时,若能实现R0切除,手术仍然是首选。既往研究和临床经验表明,新辅助阶段的免疫治疗相比靶向治疗具有更大的获益。总体而言,对于本病例,目前的治疗方法较为成功。然而,术后继续原方案的联合治疗可能带来较高的风险。建议术后通过微小残留病灶(MRD)监测,结合患者的身体状况和耐受性,开展多学科讨论(MDT),以制定个体化的后续治疗方案,从而优化患者的长期预后。
参考文献:
[1] Zhang Y, Li S, Lyu Z, Cai J, Zheng N, Li Y, Xu T, Zeng H. The co-mutation of EGFR and tumor-related genes leads to a worse prognosis and a higher level of tumor mutational burden in Chinese non-small cell lung cancer patients. J Thorac Dis. 2022 Jan;14(1):185-193. doi: 10.21037/jtd-21-1921. PMID: 35242380; PMCID: PMC8828510.
[2] Riihimäki M, Hemminki A, Fallah M, Thomsen H, Sundquist K, Sundquist J, Hemminki K. Metastatic sites and survival in lung cancer. Lung Cancer. 2014 Oct;86(1):78-84. doi: 10.1016/j.lungcan.2014.07.020. Epub 2014 Aug 2. PMID: 25130083.
[3] Ren Y, Dai C, Zheng H, Zhou F, She Y, Jiang G, Fei K, Yang P, Xie D, Chen C. Prognostic effect of liver metastasis in lung cancer patients with distant metastasis. Oncotarget. 2016 Aug 16;7(33):53245-53253. doi: 10.18632/oncotarget.10644. PMID: 27449299; PMCID: PMC5288182.
[4] Noonan KL, Ho C, Laskin J, Murray N. The Influence of the Evolution of First-Line Chemotherapy on Steadily Improving Survival in Advanced Non-Small-Cell Lung Cancer Clinical Trials. J Thorac Oncol. 2015 Nov;10(11):1523-31. doi: 10.1097/JTO.0000000000000667. PMID: 26536194.
[5] Wong WB, Wu N, Yang E, Davies J, Chae YK. Real-World Clinical and Economic Outcomes and the Role of Bevacizumab in Patients With Non-Small-Cell Lung Cancer With Liver Metastases. J Oncol Pract. 2019 Oct;15(10):e878-e887. doi: 10.1200/JOP.19.00166. Epub 2019 Sep 11. PMID: 31509482.
[6] Zhang C, Chen HF, Yan S, Wu L, Yan LX, Yan XL, Yue DS, Xu CW, Zheng M, Li JS, Liu SY, Yang LL, Jiang BY, Ou QX, Qiu ZB, Shao Y, Wu YL, Zhong WZ. Induction immune-checkpoint inhibitors for resectable oncogene-mutant NSCLC: A multicenter pooled analysis. NPJ Precis Oncol. 2022 Sep 19;6(1):66. doi: 10.1038/s41698-022-00301-8. PMID: 36123526; PMCID: PMC9485257.
[7] Duan H, Shao C, Luo Z, Wang T, Tong L, Liu H, Yao X, Lei J, Zhao J, Gao Y, Jiang T, Yan X. Perioperative sintilimab and neoadjuvant anlotinib plus chemotherapy for resectable non-small-cell lung cancer: a multicentre, open-label, single-arm, phase 2 trial (TD-NeoFOUR trial). Signal Transduct Target Ther. 2024 Oct 28;9(1):296. doi: 10.1038/s41392-024-01992-0. PMID: 39465257; PMCID: PMC11514280.
[8] Chao Zhang, et al. Neoadjuvant sintilimab plus platinum-based chemotherapy in EGFR-mutant NSCLC: An updated analysis of a phase 2 prospective trial (NEOTIDE/CTONG2104) . 2024 AATS, Abstract 176.
[9] Zhao Y, He Y, Wang W, Cai Q, Ge F, Chen Z, Zheng J, Zhang Y, Deng H, Chen Y, Lao S, Liang H, Liang W, He J. Efficacy and safety of immune checkpoint inhibitors for individuals with advanced EGFR-mutated non-small-cell lung cancer who progressed on EGFR tyrosine-kinase inhibitors: a systematic review, meta-analysis, and network meta-analysis. Lancet Oncol. 2024 Oct;25(10):1347-1356. doi: 10.1016/S1470-2045(24)00379-6. Epub 2024 Aug 16. PMID: 39159630.
[10] Jiang L, Huang J, Jiang S, Rong W, Shen Y, Li C, Tian Y, Ning J, Chen X, Yang Y, Ding Z, Li Z, Luo Q. The surgical perspective in neoadjuvant immunotherapy for resectable non-small cell lung cancer. Cancer Immunol Immunother. 2021 Aug;70(8):2313-2321. doi: 10.1007/s00262-021-02847-1. Epub 2021 Jan 29. PMID: 33512555; PMCID: PMC7844548.
[11] Marjanski T, Dziedzic R, Kowalczyk A, Rzyman W. Safety of Surgery after Neoadjuvant Targeted Therapies in Non-Small Cell Lung Cancer: A Narrative Review. Int J Mol Sci. 2021 Nov 12;22(22):12244. doi: 10.3390/ijms222212244. PMID: 34830123; PMCID: PMC8622767.
[12] Deng H, Liu J, Cai X, Chen J, Rocco G, Petersen RH, Brunelli A, Ng CSH, D'Amico TA, Liang W, He J. Radical Minimally Invasive Surgery After Immuno-chemotherapy in Initially-unresectable Stage IIIB Non-small cell Lung Cancer. Ann Surg. 2022 Mar 1;275(3):e600-e602. doi: 10.1097/SLA.0000000000005233. PMID: 34596079.
[13] Deng H, Liang H, Chen J, Wang W, Li J, Xiong S, Cheng B, Li C, Chen Z, Wang H, Zheng J, Guo Z, He J, Liang W. Preoperative immunochemotherapy for locally advanced non-small cell lung cancer: an analysis of the clinical outcomes, optimal number of cycles, and peripheral immune markers. Transl Lung Cancer Res. 2022 Dec;11(12):2364-2381. doi: 10.21037/tlcr-22-439. PMID: 36636407; PMCID: PMC9830256.