广州医科大学附属第一医院/广州呼吸健康研究院、国家呼吸医学中心、呼吸疾病全国重点实验室、国家呼吸系统疾病临床医学研究中心、广州实验室钟南山-杨子峰团队与浙江大学医学院附属第一医院、广东省中医院和中南大学等单位合作,开展的一项昂拉地韦(Onradivir,研发代号:ZSP1273)治疗成年急性无并发症甲型流感感染的多中心、双盲、随机、安慰剂对照临床II期试验,以考察该候选新药的有效性和安全性,临床试验结果以研究论文“Efficacy and safety of onradivir in adults with acute uncomplicated influenza A infection: a multi-center, double-blind, randomized, placebo-controlled phase 2 trial”于近期发表在医学顶刊柳叶刀子刊The Lancet Infectious Diseases期刊。

流行性感冒(以下简称流感)是由流感病毒引起的一种急性呼吸道传染病,甲型和乙型流感病毒每年呈季节性流行,其中甲型流感病毒可引起全球大流行。柳叶刀报道,中国正常年份死于流感相关的患者约8.81万人。根据中国国家流感中心发布的《流感周报》,2023年第6周至第20周(2023年2月6日至5月21日)全国流感监测点共累积进行169185例监测,其中甲型流感50790例,甲流发病率约30%,占全部报告病例99.9%左右。尽管目前用于临床流感治疗的一线药物神经氨酸酶抑制剂奥司他韦和RNA聚合酶PA亚型抑制剂玛巴洛沙韦疗效确切,但HA和NA频繁突变,存在耐药率高、副作用大等不足。多项荟萃分析提示没有证据表明奥司他韦可以降低住院、肺炎或肺炎-中耳炎-鼻窦炎的复合症状发生的可能性,2017年WHO已不推荐预防性使用奥司他韦,并限制奥司他韦用于确诊或疑似流感重症住院患者引起的严重疾病的治疗。文献报道,口服一次玛巴洛沙韦后发生耐药性突变比例为2.2%~23.4%,儿童患者发生耐药比例更高。由于流感病毒高突变率以及病毒之间重组现象的发生,已有的抗流感药物难以应对多变的流感病毒,新型作用机制抗流感病毒药物的研发以应对严峻的公共健康安全和未被满足的临床需求尤为迫切。
昂拉地韦是在强生公司早期开发的PB2抑制剂VX-787的结构基础上优化而来。研究团队通过合理药物设计,把母核中的吡咯环改为吡唑环,并在嘧啶环6位引入环丙基占据PB2疏水性口袋,提高亲合力,进而有效提升抗病毒活性。昂拉地韦是具有全新作用机制和全球自主知识产权的一类创新药物,临床上拟用于成人单纯性甲型流感的治疗,是国内首个获批临床试验的治疗甲型流感的小分子RNA聚合酶PB2蛋白抑制剂。昂拉地韦作为“帽子”结构类似物与RNA聚合酶PB2亚基结合,抑制RNA聚合酶复合物复制功能的正常启动,从而抑制病毒生命周期基因组的转录和复制,达到抗甲型流感病毒的作用。本团队深入系统的在酶活抑制、细胞水平抗病毒感染和小鼠与雪貂模型中对动物的感染保护症状恢复等方面验证了昂拉地韦优异的体内外抗病毒药效,并深入考察了药代动力学性质(Pharmaceuticals 2023, 16(3), 365)。昂拉地韦临床前研究结果表明,其对多种甲型流感病毒的抑制能力显著优于核酸内切酶抑制剂玛巴洛沙韦以及神经氨酸酶抑制剂奥司他韦,并且对奥司他韦耐药病毒株、玛巴洛沙韦耐药病毒株和高致病性禽流感病毒株均具有很强的抑制作用;体内药效试验较VX-787和奥司他韦有更佳的保护动物、降低动物肺部病毒滴度的药效,并且与奥司他韦联合用药展现高度协同作用。有望作为抗击甲型流感的一道新防线。在进一步完成临床前安全性评价后,昂拉地韦顺利于2018年获得国家药品监督管理局(NMPA)审批的临床试验批件。

在完成中国健康人的I期临床研究后,为进一步考察昂拉地韦片的临床有效性和安全性,作为该项目组长单位广州医科大学附属第一医院和临床总负责人(Leading PI)的钟南山/杨子峰团队组织全国20家中心开展了一项昂拉地韦片治疗成年急性无并发症甲型流感感染的全国多中心、双盲、随机、安慰剂对照II期临床试验。
2019年12月7日至2020年5月18日,我们在全国20家临床中心开展了这项多中心、随机、双盲、安慰剂对照试验,共入组172例研究对象为急性无并发症的中国成年甲型流感患者:首次就诊时甲型流感快速抗原检测(RAT)阳性,腋温≥38.0 ℃,症状出现时间≤48小时,并伴有至少一种中度或以上的全身症状和呼吸系统症状。孕妇、对昂拉地韦过敏,或在入组前7天内接受过任何流感抗病毒药物治疗的患者则被排除在外。合格的受试者通过中央随机系统(IWRS)被随机分为四组(1:1:1:1):昂拉地韦200 mg每日两次(BID)、400 mg每日两次(BID)、600 mg每天一次(QD)或匹配的安慰剂(图1),疗程5天。主要疗效指标是意向治疗(ITT)人群中七项流感症状持续缓解的时间(TTAS),该人群包括所有至少接受一次研究药物的患者。受试者使用4级量表(0,无;1,轻度;2,中度;3,重度)对7种流感症状的严重程度进行自评,并记录和分析了ITT人群中所有患者的治疗期间不良事件(TEAE)。本试验在Clinical Trials.gov注册号码:NCT04024137。
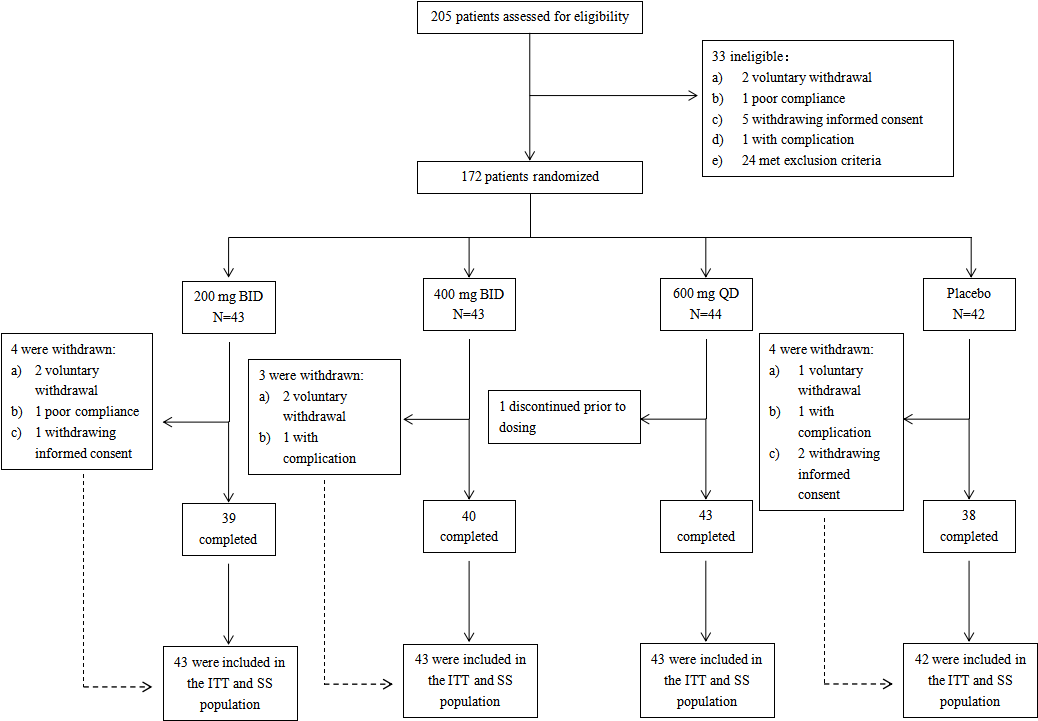
图1. 昂拉地韦全国多中心、双盲、随机、安慰剂对照临床II期试验流程
主要疗效结果显示,与安慰剂组TTAS中位时间62.87小时(IQR 36.40-113.25小时)相比,所有三个昂拉地韦组的TTAS中位时间均降低:200 mg,46.92小时(IQR 24.00-81.38小时);400mg,54.87小时(IQR为23.67-110.62小时);600mg,40.05小时(IQR 17.70~65.82小时);其中,昂拉地韦600mg组与安慰剂组的差异为22.82小时(P=0.0330)。所有昂拉地韦组的中位退烧(腑温<37℃)时间均明显短于安慰剂组(安慰剂组,60.27小时;昂拉地韦组,200mg, 31.93小时,HR 1.65, P=0.0303;400mg, 25.33小时,HR 1.69,P=0.0327;600mg, 23.88小时,HR 1.84,95%CI 1.88-2.88,P=0.0207)(图3)。昂拉地韦缩短了病毒浓度可测持续时间(安慰剂组,71.85小时;昂拉地韦组,200 mg,41.95小时,P=0.0037;400 mg,62.26小时,P=0.0048;600 mg,41.77小时,P=0.0066)。最常见的AE是腹泻(40.94%);本研究未观察到严重不良反应(表1)
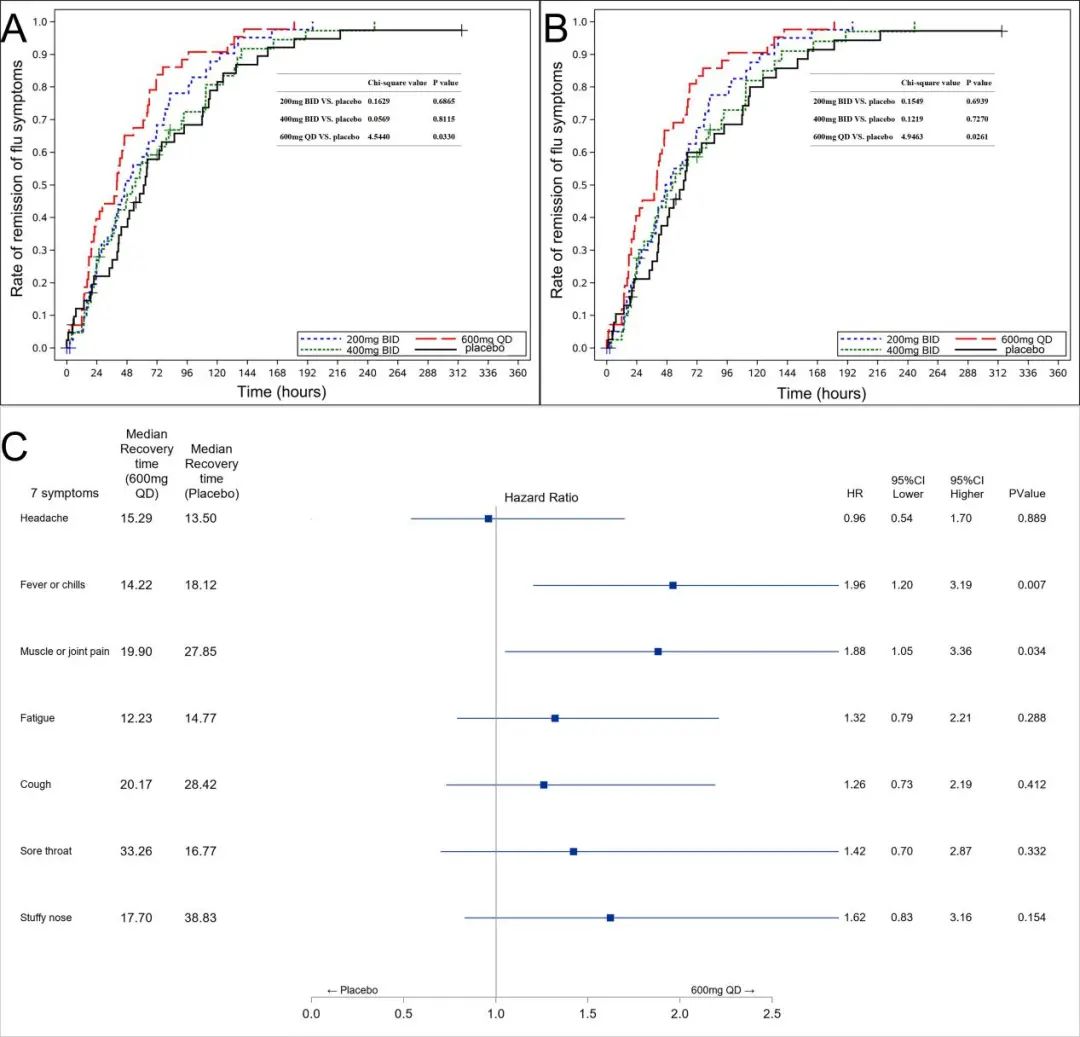
图2. 昂拉地韦主要疗效结果
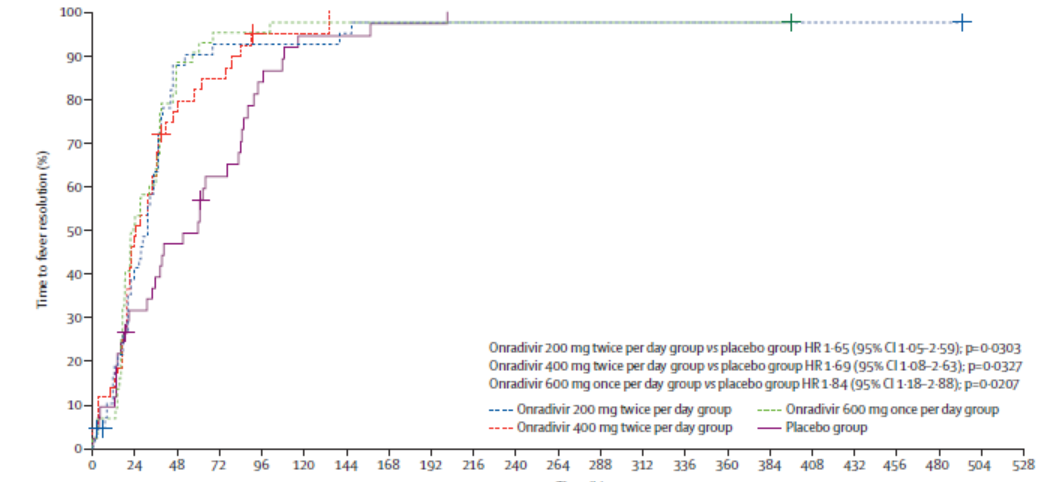
图3. 所有昂拉地韦组的退烧时间均明显短于安慰剂组
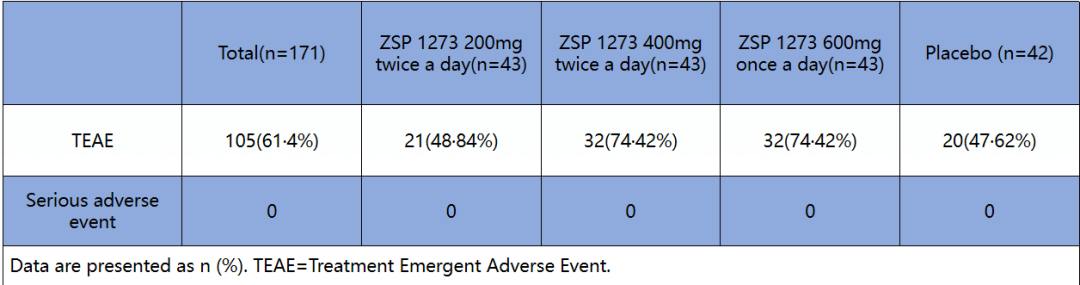
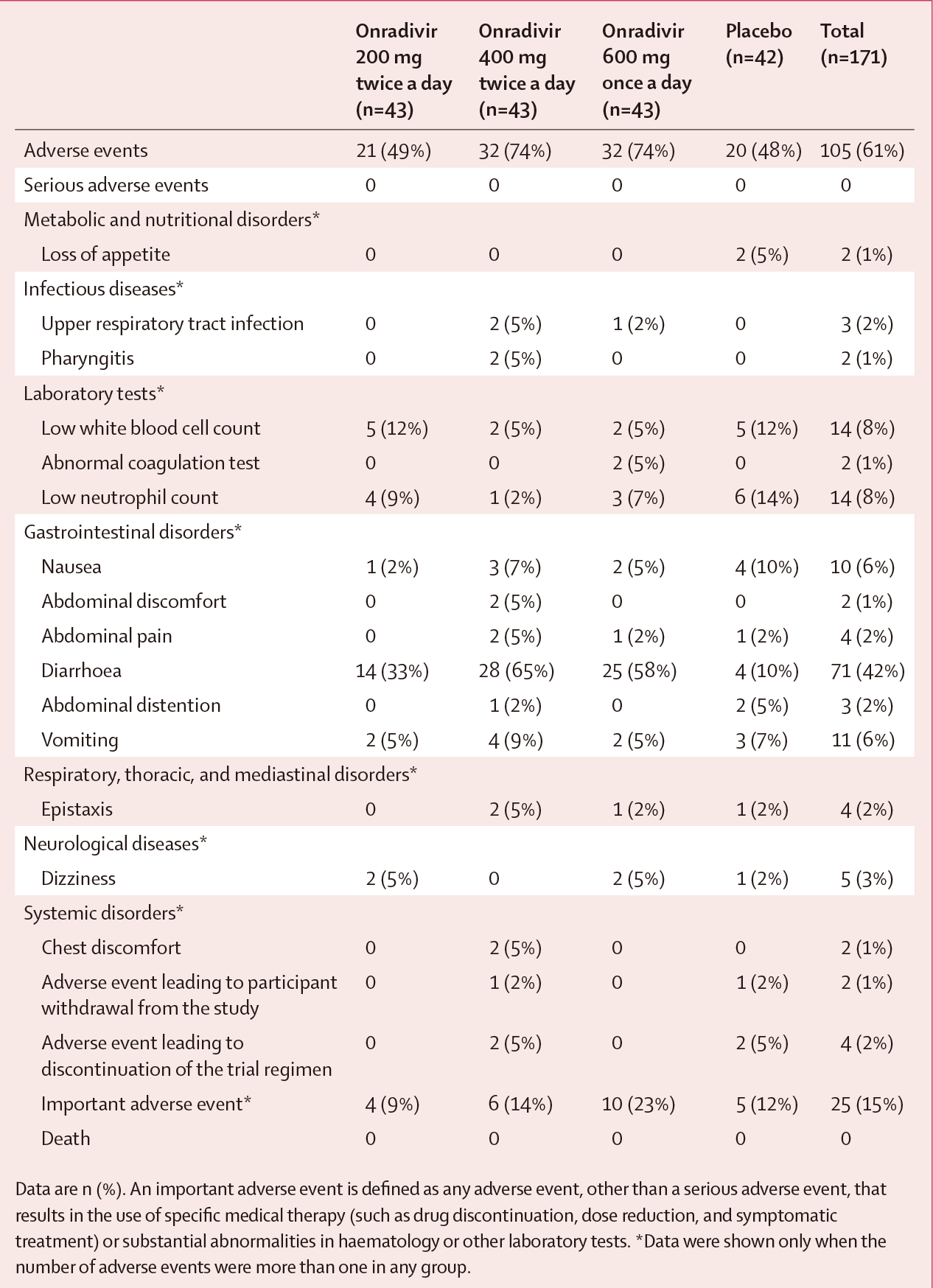
表1. 昂拉地韦组不良事件列表
该项研究结果表明, 昂拉地韦能够显著缩短流感七项症状(咳嗽、咽痛、头痛、鼻塞、发热或寒颤、肌肉或关节痛和疲劳)缓解时间和缩短发热时间,并能快速降低和清除体内流感病毒,且安全性耐受性良好。
基于临床II期试验的优异疗效和良好安全性,在全国研究总负责人钟南山/杨子峰课题组带领下,进一步开展了昂拉地韦片治疗成人单纯性甲型流感的随机、双盲、安慰剂或奥司他韦对照的III期临床研究(试验设昂拉地韦片600mg QD组、奥司他韦胶囊75mg BID和安慰剂组,共给药5天,观察21天),拟入组744例,实际入组750例,在全国80余家中心开展。至发稿日该项试验已完成,并达到临床观察终点,具体数据将进一步披露。昂拉地韦已提交NDA并获CDE受理,如果顺利,将于今年获得上市批文,有望成为全球首个抗甲流治疗的PB2新药,将为解决重大公共卫生事件提供新的治疗选择。
广州医科大学附属第一医院/广州呼吸健康研究院、国家呼吸医学中心、呼吸疾病全国重点实验室、国家呼吸系统疾病临床医学研究中心、广州实验室钟南山院士为本项目临床总负责人,是本文唯一通讯作者,国家呼吸系统疾病临床医学研究中心、广州实验室杨子峰教授、李征途博士、占扬清主治医师、林正诗研究员、方中豪硕士和浙江大学医学院附属第一医院徐小微主任医师、广东省中医院林琳教授、中南大学李海军博士生为论文共同第一作者,该项目获得国家中医药多学科创新团队项目、国家自然科学基金、广东省科学技术基金、广州市科技规划项目、广州实验室应急重点项目、澳门科技发展基金、广东众生睿创生物科技有限公司等项目支持,试验数据管理和统计分析由上海韧致数据技术有限公司支持。