
知名免疫学期刊《Frontiers in Pharmacology》
近期,广州医科大学附属第一医院中医科王鹏副教授团队与深圳北京中医药大学研究院史渊源教授团队合作,通过液质联用技术、系统药理学策略和体内外实验多种技术手段联合应用,研究了清肺理痰方治疗急性肺损伤/急性呼吸窘迫综合征的潜在抗炎、抗氧化机制。其成果以题为“Qingfei Litan Decoction Against Acute Lung Injury/Acute Respiratory Distress Syndrome: The Potential Roles of Anti-inflammatory and Anti-oxidative Effects”的论文于2022年5月23日被国际知名药学期刊《Frontiers in Pharmacology》【2022 IF:5.81】收录。该杂志最新JCR药学分区1区,中科院药学及药理学分区2区。
急性肺损伤(Acute lung injury,ALI)及其严重形式急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),作为急性呼吸衰竭综合征,其是以进行性动脉低氧血症和呼吸困难为特征。诱发该病的风险因素包括:肺炎、败血症、胃内容物误吸以及重大创伤等。ALI/ARDS作为危及生命的疾病,其死亡率仍然很高,28天死亡率可达约20-40%。2012年公布的柏林定义是目前ARDS的通用定义:根据低氧血症将ARDS分为轻度(200mmHg < PaO2/FIO2 ≤ 300mmHg)、中度(100mmHg < PaO2/FIO2 ≤ 200mmHg)和重度(PaO2/FIO2 ≤ 100mmHg)。尽管已经进行了多年的临床试验,ARDS的治疗选择仍然有限,目前仍然是以机械通气为主的支持性治疗。靶向ARDS病理生理改变的治疗药物仍然尚有争议,如糖皮质激素、表面活性剂、非甾体抗炎药、β2激动剂、他汀类药物和沙丁胺醇等。炎症介质和氧化剂介导的组织损伤是 ARDS发病机制中的重要事件。肺的炎症-氧化损伤增强中性粒细胞穿透内皮/上皮屏障的通透性,释放细胞毒性因子,包括多种促炎细胞因子TNF-α、IL-6、IL-1β和活性氧等。同时,必需生物分子和细胞的损伤会导致过度的炎症反应,这会进一步放大组织损伤和肺水肿。因此,抑制过度炎症和氧化应激将是预防和治疗 ALI/ARDS的有益基本策略。

据报道,许多天然化合物由于其抗炎和抗氧化活性以及相对较小的副作用而可能抑制ALI的发展,因此,中医药可能是治疗ALI/ARDS的一个有潜力的新选择。清肺理痰方源自《国家中医药管理局医政司颁布的《22个专业95个病种中医诊疗方案(2010)》中“风温肺热病诊疗方案”中痰热壅肺证推荐方药。该方由青天葵,石膏,瓜蒌皮,黄芩,浙贝母,鱼腥草,芦苇茎,苦杏仁,桔梗,甘草十味中药所组成。其创始人为广东省名中医潘俊辉教授,该方具有清热宣肺、化痰散瘀、益气润肺等功效。该方在临床应用多年,多用于治疗临床上的急性肺部感染疾病。然而清肺理痰方中确切的化学成分、靶点、潜在调节通路尚不清楚,我们有必要利用新的技术手段进一步对清肺理痰方进行挖掘与探索,为临床应用提供可靠的基础研究,清肺理痰方将是一个在ALI/ARDS治疗中十分有前景的传统处方。

图1 UHPLC-MS在正负模式下的全离子色谱图
该研究首先使用液质联用技术(ultra high performance liquid chromatography coupled with mass spectrometry,UHPLC-MS)确定了清肺理痰方提取物中的化学成分(图1),根据保留时间和分子离子峰,与TCMSP数据库公布的数据、准确的质量、色谱行为和碎片离子质量进行比较,共鉴定出47种化学成分,其中包括35种黄酮类化合物。据报道,黄酮类化合物在预防急性肺损伤、溃疡性结肠炎、骨质疏松症、非酒精性脂肪性肝病、阿尔茨海默病和其他疾病中发挥着重要的抗炎、抗氧化作用。
随后,研究团队对清肺理痰方中鉴定出的47种成分进行了系统药理学分析。通过对化学成分以及疾病进行了潜在靶点的收集,在排除重复靶点后,获得了627个清肺理痰方中成分对应的靶点,以及2547个ALI/ARDS疾病相关靶点。二者交集后,得到有328个交集靶点,这可能是清肺理痰方治疗ALI/ARDS的关键靶点(图2)。

图2 韦恩图
(A)从两个数据库收集的ALI/ARDS的潜在靶点(B)清肺理痰方(QFLT)和ALI/ARDS之间潜在的重叠目标
基于328个交集靶点,进一步构建了成分-靶点网络(图3)。这个网络由373个节点和1718条边组成。代表网络节点平均连通性的平均邻居数(average number of neighbors)为9.212,网络中心性(centralization)和异质性(heterogeneity)分别为0.178和1.633,这表明中药复方具有多药理学特征。这些结果表明,清肺理痰方中的中药成分以“多成分、多靶点”的方式协同治疗ALI/ARDS。Acacetin(degree 73,Neighborhood Connectivity 13),Baicalein(degree 71,Neighborhood Connectivity 12),Luteolin(degree 61,Neighborhood Connectivity 14),Liquiritigenin(degree 75,Neighborhood Connectivity 10),Wogonin(degree 71,Neighborhood Connectivity 13),以及Isorhamnetin(degree 68,Neighborhood Connectivity 14)可能是清肺理痰方治疗ALI/ARDS的重要抗炎和抗氧化成分。这表明清肺理痰方的抗炎和抗氧化作用与多种抗炎和抗氧化成分对疾病靶点的调节有关。
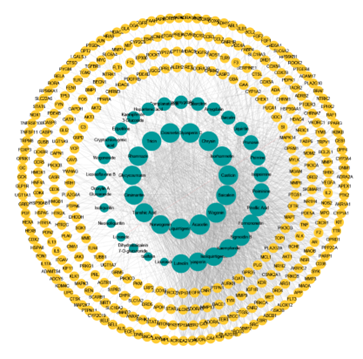
图3成分-靶点-网络图
从该网络中可能会发现潜在的重要靶点和化合物,它们可能在免疫和炎症反应以及氧化应激中发挥作用。
为了进一步探索靶点蛋白相互作用的功能,研究团队通过cytoscape中的cytohubba app对从STRING数据库中获得的PPI网络进行了进一步的分析(图4)。通过基因注释,我们发现PPI网络中存在许多免疫、炎症反应(细胞因子如TNF、IL2、IL5和模式识别受体如TLR4、TLR2)和氧化应激(氧化还原酶,如CYP450s和ALOXs)相关的靶点。结果提示清肺理痰方具有抗感染、抗炎、抗氧化、减轻细胞因子风暴和机体损伤的潜在功效。

图4 潜在靶点的PPI network
为了进一步探究清肺理痰方在ALI/ARDS中的抗炎和抗氧化功能,利用DAVID数据库对交集靶点进行了潜在的GO和KEGG通路富集分析(图5)。其中免疫和炎症反应相关的重要靶点如TNF、RELA、NFKB1、IKBKB和TLR4富集到TNF信号通路和Toll样受体信号通路。且TNF信号通路的激活在IL-1β、TNF-α和IL-6等促炎细胞因子的产生中起着不可或缺的作用。TNF信号对先天免疫至关重要,但失控的TNF信号在许多炎症性疾病和癌症相关炎症的发病机理中也起着重要作用。当TNF与靶细胞表面上的受体结合时,介导TNF的有益和有害作用的信号被启动。而TLR4作为ALI的易感基因,TLR4-TRIF-TRAF6信号传导是ALI的关键途径,肺内氧化剂的产生可引发肺损伤,并通过TLR4-TRIF刺激肺巨噬细胞产生促炎细胞因子,这表明氧化应激和先天免疫在ALI中起着关键作用。因此,研究团队将进一步关注TNF信号通路、Toll样受体信号通路,并在随后的体内和体外实验中对下游生物标志物进行检测(TNF-α、IL-1β、IL-6)。

图5(A) GO分析和(B)KEGG富集通路
研究团队发现清肺理痰方治疗可以明显改善ALI小鼠体内炎症水平。从H&E染色的结果来看,与Control组相比,脂多糖(Lipopolysaccharide,LPS)组肺泡结构严重受损,肺泡腔出血,伴有大量炎性细胞浸润,肺间质水肿,肺泡间隔较对照组明显增厚,炎症评分以及肺组织的干湿比升高,提示急性肺损伤模型制备成功;而与LPS组相比,清肺理痰方可以减轻LPS诱导的ALI小鼠的肺形态学损伤,降低炎症评分以及肺组织的干湿比(图6)。与Control组相比,LPS组的总细胞、巨噬细胞和中性粒细胞的数量显著增加(P < 0.01),清肺理痰方给药可以显著减轻LPS诱导小鼠的肺泡微环境中总细胞、巨噬细胞及中性粒细胞的数目(P < 0.05)。与Control组相比,LPS组的肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中TNF-α、IL-6和IL-1β的水平显著升高(P < 0.01);而与LPS组相比,清肺理痰方给药可以降低BALF中炎症因子TNF-α、IL-6、IL-1β的水平(P < 0.05),并呈现出一定的剂量依赖性。在小鼠肺组织qPCR实验中,与Control组相比,LPS组TNF-α、IL-6、IL-1β mRNA水平显著增加(P < 0.01),而清肺理痰方治疗后,可以抑制ALI小鼠肺组织中TNF-α、IL-6和IL-1β mRNA水平的增加(P < 0.05)(图7)。
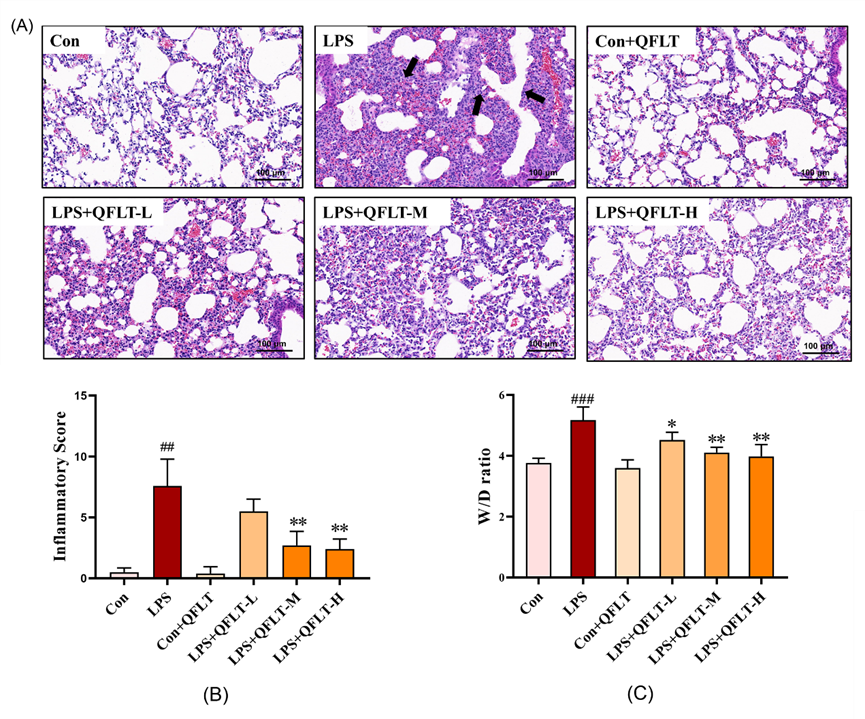
图6 清肺理痰方对LPS诱导的急性肺损伤的影响(A)H&E染色肺组织病理切片(×100)黑色箭头表示肺泡结构严重受损,肺泡腔出血并有炎性细胞浸润(B)炎症评分(C)干湿比

图7 清肺理痰方治疗对小鼠体内炎症水平的影响。(A-C)总细胞数,巨噬细胞数以及中性粒细胞数的变化情况(D-F)BALF中的炎症因子水平变化(G-I)
研究团队进一步探究了清肺理痰方对LPS诱导的巨噬细胞的影响。与Control组相比,LPS组中巨噬细胞分泌的促炎细胞因子TNF-α、IL-6和IL-1β水平显著升高(P < 0.01);与LPS组相比,清肺理痰方治疗可以降低巨噬细胞分泌的促炎细胞因子TNF-α、IL-6和IL-1β水平(P < 0.05),并具有剂量依赖性以及时间依赖性(图8)。团队研究表明,清肺理痰方可以明显减轻体内外的炎症反应。
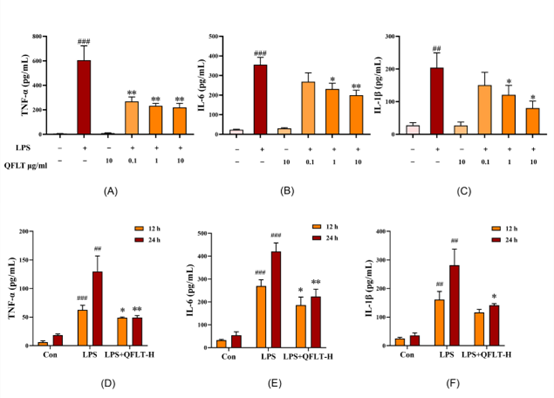
图8 清肺理痰方对LPS诱导的巨噬细胞分泌促炎细胞因子(TNF-α、IL-1β和IL-6)的影响
由于过度的炎症反应和失衡的氧化应激在ALI的发病机制中至关重要。研究团队进一步探究了清肺理痰方治疗对体内氧化应激水平的影响(图9),发现清肺理痰方治疗可以抑制ALI小鼠肺组织中的MDA水平,并减少了SOD和GSH-Px的消耗(P < 0.05)。在ALI/ARDS中,肺内氧化剂的产生可导致肺泡上皮细胞的损伤。于是,研究团队也进一步探究了清肺理痰方治疗对LPS诱导的肺泡上皮A549细胞的作用。结果表明,清肺理痰方预处理以剂量依赖性的方式增强了LPS诱导的A549细胞活力(P < 0.05)。此外,与LPS组相比,清肺理痰方预处理能提高LPS诱导的A549细胞中GSH含量(P < 0.05),并显著减少ROS生成。团队研究表明,清肺理痰方可以明显改善体内外的氧化应激水平。

结论
急性肺损伤/急性呼吸窘迫综合征作为威胁生命的疾病,目前其发病率和死亡率仍然很高,迫切需要寻找新的治疗方法。本研究将液质联用技术、系统药理学策略与体内和体外实验相结合,进而探究了清肺理痰方治疗急性肺损伤/急性呼吸窘迫综合征的潜在抗炎和抗氧化机制,为清肺理痰方的临床应用提供研究基础,为中药复方的未来研究提供新的策略。
该研究由王鹏团队与深圳北京中医药大学研究院史渊源教授团队共同合作完成。
作者简介
王鹏
博士,副教授,硕士研究生导师,广东省医学杰出青年人才。中国中西医结合学会呼吸专委会青委,广东省中西医结合学会呼吸专委会常委,中华中医药学会感染分会委员。广州市卫健委第三批“中医优秀临床人才”,“潘俊辉广东省名中医传承工作室”项目负责人。国家第六批名老中医药专家学术经验继承人、广东省首批中医师师承项目继承人。

王鹏主任(左一)与潘俊辉教授(右一)
史渊源教授

深圳北京中医药大学研究院执行院长,曾任北京中医药大学生命科学学院常务副院长,特聘教授。博士毕业于中科院生物物理所生物大分子国家重点实验室,师从邹承鲁院士,王志珍院士。2005-2008担任哈佛大学医学院病理学系博士后。2008-2010担任哈佛大学医药学系、伯明翰妇女医院资深博士后,从事肺纤维化疾病研究。2011-2014担任美国Lovelace呼吸系统研究所副研究员,肺纤维化研究组负责人,LLARR奖学金导师科学家,从事肺纤维化疾病及药物开发研究。(主持工作),衰老相关团队负责人,从事中西医防治肺纤维化及老年痴呆研究。
美国泛亚机械科学工程协会(Society of Asian Scientists and Engineers)终身会员,美国Sigma Xi学会会员,美国美国胸腔学会(American Thoracic Society)会员,深圳市保健科技学会副会长。
获得荣誉:中国科学院 院长优秀奖(2005),深圳市 海外高层次人才“孔雀人才”(2018),中华中医药学会 科学技术奖-优秀管理人才奖(2020)。